癌症疫苗提高结直肠癌患者总生存期三倍!创新疗法有效缓解PD-1耐药… | 一周盘点
癌症疫苗提高结直肠癌患者总生存期三倍!创新疗法有效缓解PD-1耐药…
·
·
·
1. 玻璃体内注射的双重基因疗法4D-150治疗湿性年龄相关性黄斑变性(AMD),可减少眼内抗VEGF注射需求患者96.7%的年化注射率。2. 突变柠檬酸脱氢酶-1(mIDH1)抑制剂olutasidenib治疗血液癌症的早期临床数据亮眼,PDUFA的预计日期定为2023年2月15日。3. 潜在“first-in-class”的新型放射增敏剂NBTXR3的联合疗法效果亮眼,具有扩展到任何可以通过放疗治疗的实体肿瘤和任何联合治疗方案的潜力。4. 个体化癌症疫苗GRANITE联合免疫检查点抑制剂,使微卫星稳定型结直肠癌患者的总生存期翻3倍。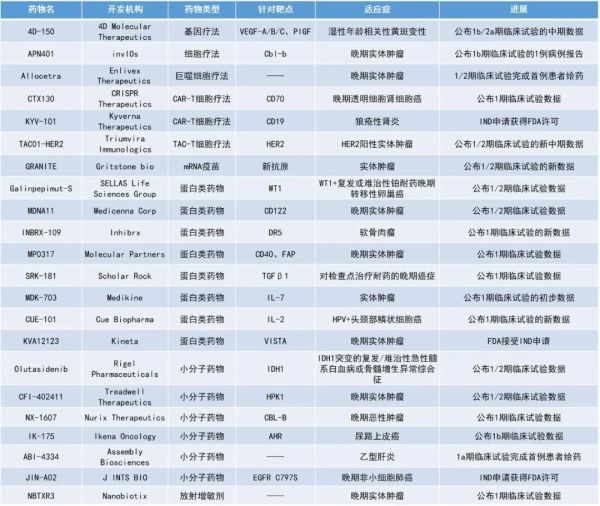
药明康德内容团队整理

4D Molecular Therapeutics公司公布了其玻璃体内注射的双重基因疗法4D-150用于治疗湿性AMD的早期临床数据。湿性AMD是一种影响视网膜中央黄斑部的病症,主要由脉络膜新生血管所导致,即在黄斑部有不正常的血管增生。4D-150由表达阿柏西普和抗VEGF-C的RNAi有效载荷以及能够在玻璃体内进行递送的专有载体R100组成,能够抑制4种血管生成因子:VEGFA、B、C和PlGF。新闻稿指出,4D-150是首款旨在抑制驱动血管生成的所有四种VEGF相关分子的视网膜基因疗法。此次公布的数据显示,玻璃体内注射4D-150后,入组前12个月的平均年化抗VEGF注射频率约为11次的高需求患者的年化抗VEGF注射率降低了96.7%,80%的患者在4D-150给药后长达10个月内未接受任何补充阿柏西普注射。截至目前,4D-150的安全性和耐受性良好,未报告有临床意义的眼内炎症或眼压过低。Olutasidenib:公布1/2期临床试验数据
Rigel Pharmaceuticals公司公布了在研小分子mIDH1抑制剂olutasidenib单药或与阿扎胞苷(azacitidine)联合治疗复发/难治性mIDH1急性髓系白血病(AML)或骨髓增生异常综合征(MDS)的早期临床数据。IDH1是所有细胞正常代谢需要的一种天然酶,当发生突变时,它的活性可促进血液恶性肿瘤和实体瘤的发生。据统计,6-9%的AML患者携带IDH1突变。Olutasidenib旨在选择性结合并抑制突变的IDH1酶,有可能通过降低2-羟基戊二酸(2-HG)水平和恢复正常的细胞分化而为患者提供治疗益处。此次公布的数据显示,在接受联合治疗的患者中,初治AML患者的总缓解率(ORR)为77%,完全缓解(CR)+CR伴部分血液学恢复缓解率(CR/CRh)为54%。在MDS队列中,9例有响应的患者中有4例实现了突变清除,单药治疗和联合治疗均观察到CR,其中联合治疗组的ORR为86%,CR率为57%。Olutasidenib在AML和MDS患者中均具有良好的耐受性,未发生剂量限制性毒性。总体而言,单药治疗和联合治疗组的不良事件相似且可控。新闻稿指出,olutasidenib的新药申请(NDA)正在接受美国FDA的审查,PDUFA的预计日期定为2023年2月15日。
Nanobiotix公司公布了其潜在“first-in-class”的新型放射增敏剂NBTXR3在放疗激活后接着使用PD-1抑制剂的1期临床试验的积极数据。NBTXR3由功能化二氧化铪(HfO2)纳米颗粒组成,经由一次性瘤内注射给药并通过放射疗法激活。它的物理作用机制为:旨在通过放疗激活,诱导被注射肿瘤内大量的肿瘤细胞死亡,随后触发适应性免疫反应和长期的抗癌记忆。得益于该物理作用机制,Nanobiotix公司认为NBTXR3可以扩展到任何可以通过放疗治疗的实体肿瘤和任何联合治疗方案中,特别是与免疫检查点抑制剂联合。此次公布的研究结果显示,该疗法组合是可行的且耐受性良好。在可评估的21例患者中,71.43%被观察到目标病灶相对于基线的客观缩小,其中42.86%患者的病灶客观缩小超过30%,38.1%患者的全身性疾病控制持续了超过6个月。71.43%(15例)患者对先前的抗PD-1治疗耐药,在这些患者中有10例观察到了肿瘤的消退。此前,NBTXR3曾获得美国FDA授予用于治疗局部晚期头颈部鳞状细胞癌患者的快速通道资格。
Gritstone bio公司公布了其在研个体化癌症疫苗GRANITE联合免疫检查点抑制剂,作为一线维持疗法,以治疗晚期实体瘤患者的临床1/2期试验最新数据。这款癌症疫苗的设计首先从患者体内获取活检组织,对肿瘤进行测序,然后利用其专有的人工智能平台EDGE识别新抗原,再利用腺病毒载体(GRT-C901)和自我扩增mRNA载体(GRT-R902)递送筛选出的新抗原,旨在引发显著的T细胞反应,特别是CD8+细胞毒性T细胞。此次公布的新数据显示,在曾接受过至少2线疗法的转移性微卫星稳定型结直肠癌(MSS-CRC)患者群中,此组合疗法帮助病患达到分子缓解,中位总生存期(OS)超过22个月,是过去接受3线疗法MSS-CRC患者的3倍(中位OS仅6-7个月)。invIOs公司公布了其潜在“first-in-class”的细胞疗法APN401的1b期临床试验的1例病例报告。研究表明,Cbl-b也是一种免疫检查点,APN401可以通过使用siRNA暂时减少自体外周血单核细胞(PBMC)中的Cbl-b的表达来增强免疫反应。Cbl-b沉默的自体PBMC可以在大约24小时内完成制造并回输给患者。目前,已有1例先前接受过11线治疗的转移性阑尾癌患者的疾病稳定了超过六个月。CRISPR Therapeutics公司公布了其细胞疗法CTX130用于治疗复发或难治性透明细胞肾细胞癌(RCC)的1期临床试验数据。CTX130是健康供体衍生的CRISPR/Cas9基因编辑的同种异体CAR-T细胞疗法,靶向CD70。CD70是一种在多种实体肿瘤和血液恶性肿瘤上表达的抗原。此次公布的数据显示,CTX130显示出可耐受的安全性,没有脱靶毒性,并具有令人鼓舞的抗肿瘤活性,1例患者实现了持久的CR。CTX130在经过大量预处理的RCC患者群体中的DCR为77%,观察到的最长疾病稳定持续时间为7.8个月,并且在数据截止时仍在持续。KYV-101是一款处于临床阶段、靶向CD19的CAR-T细胞疗法,其特性尤其适用于治疗B细胞驱动的自身免疫性疾病,如狼疮性肾炎、系统性硬化症和炎性肌病。临床前研究证明,该疗法可在疾病模型的血液循环和组织中,诱导深度和完全的B细胞耗竭,产生显著疗效。TAC01-HER2:公布1/2期临床试验的新中期数据Triumvira Immunologics公司公布了其TAC-T细胞疗法TAC01-HER2用于人类表皮生长因子受体2(HER2)阳性实体肿瘤的1/2期临床试验数据。TAC01-HER2是一种新型的细胞疗法,由基因工程自体T细胞组成,该T细胞表达T细胞抗原偶联剂(TAC),并可识别HER2。该疗法使用了Triumvira Immunologics专有的TAC平台技术,能以不同于CAR-T和TCR-T细胞疗法的方式激活天然T细胞功能。新的中期数据表明,TAC01-HER2具有良好的耐受性,在两个更高剂量的队列(队列2和队列3)中观察到临床活性,队列3的DCR为67%(n=3)。此外,在队列2中观察到了持续的临床益处。Galinpepimut-S:公布1/2期临床试验数据SELLAS Life Sciences Group公司公布了其靶向WT1蛋白的潜在“first-in-class”肿瘤免疫治疗新药Galinpepimut-S联用PD-1抑制剂pembrolizumab用于WT1+复发或难治性铂耐药晚期转移性卵巢癌的早期临床数据。该药由4条多肽链构成,抗原表位多达25个,适用于全球范围内绝大多数人类白细胞组织相容性抗原(HLA)类型,能够激发自身免疫系统对WT1抗原强烈的免疫反应。研究结果显示,使用该组合疗法患者的ORR为6.3%,疾病控制率(DCR)为50.1%(在检查点抑制剂单药治疗的类似患者群体研究中,该数据为37.2%),中位总生存期(OS)为18.4个月(同上类似患者群体研究中,该数据为13.8个月),中位无进展生存期(PFS)为12周(同上类似患者群体研究中,该数据为8周)。此外,在PD-L1表达的患者中观察到了生存和疾病控制方面的获益。Medicenna Corp公司公布了其下一代长效IL-2超级激动剂MDNA11治疗晚期实体肿瘤的早期临床结果。MDNA11具有优秀的CD122(IL-2受体β)结合作用,而没有CD25(IL-2受体α)亲和力,从而能优先刺激癌症杀伤效应T细胞和NK细胞。在该研究中,MDNA11对抗癌免疫细胞的选择性和剂量依赖性刺激表明,其抗肿瘤活性可能会随着剂量的持续增加而增加。此外,新数据再次证实该候选药物有潜力克服IL-2疗法的主要安全性、药代动力学和药效学局限性。Inhibrx公司公布了其四价死亡受体5(DR5)激动抗体INBRX-109用于治疗软骨肉瘤的1期临床试验的新数据。DR5是肿瘤坏死因子相关细胞凋亡诱导配体(TRAIL)的受体。正常细胞对DR5介导的细胞死亡不太敏感。INBRX-109旨在利用多种癌症类型中DR5激活诱导的肿瘤偏向性的直接细胞死亡。此次公布的数据显示,在33例可评估的患者中,观察到的DCR为87.9%,其中2例(6.1%)患者为部分缓解(PR),27例(81.8%)患者为SD。临床获益是持久的,14例患者的临床获益超过了6个月,最长的SD持续时间为20个月。截至目前,中位PFS为7.6个月。Molecular Partners公司公布了其新型蛋白质药物MP0317治疗实体肿瘤的1期临床试验数据。由于第一代CD40激动剂具有潜在的全身性毒副作用,这类药物的开发面临着挑战。MP0317旨在通过同时结合免疫刺激物CD40以及一种在肿瘤内高度表达的成纤维细胞活化蛋白(FAP),特异性激活肿瘤微环境中的免疫细胞,从而解决此前CD40激动剂存在的局限性。此次公布的数据显示,MP0317的安全性和耐受性良好,尚未观察到剂量限制性CD40相关的全身毒性,也没有炎性细胞因子释放的迹象。此外,在肿瘤组织活检中观察到局部CD40的激活。Scholar Rock公司公布了其旨在克服晚期癌症患者对检查点治疗的耐药性的单克隆抗体SRK-181的1期概念验证试验数据。TGFβ1是在许多人类肿瘤类型中表达的主要TGFβ亚型。研究表明,TGFβ1是免疫抑制肿瘤微环境的关键贡献者。SRK-181是一种选择性的潜在的TGFβ1激活抑制剂,与抗PD-(L)1疗法联合使用时,有潜力克服检查点治疗耐药问题,同时可能避免其他非选择性TGFβ抑制方法存在的心脏毒性。此次公布的数据显示,所有剂量下的SRK-181通常都具有良好的耐受性,没有观察到剂量限制性毒性。此外,在PD-1抑制剂耐药的透明细胞肾细胞癌患者中观察到两例确认的PR。Medikine公司公布了其开发的半衰期延长的IL-7类似物MDK-703在健康志愿者中的早期临床数据。MDK-703是一种免疫球蛋白Fc片段-肽融合蛋白,含有使用Medikine平台技术发现的IL-7 PEPTIKINE(细胞因子的肽模拟物)。MDK-703比其模拟的IL-7细胞因子小得多,在结构上与天然的细胞因子无关,不会产生中和天然IL-7的抗药物抗体(ADA),这是此前在IL-7制品应用于人体试验中时经常会观察到的问题。此次公布的结果显示,MDK-703肌肉注射剂量在健康受试者中是安全且耐受性良好的,并且对血液中的免疫细胞具有类似IL-7的作用。Treadwell Therapeutics公司公布了其潜在“first-in-class”的造血祖细胞激酶1(HPK1)免疫调节小分子抑制剂CFI-402411单药或与PD-1抑制剂pembrolizumab联用治疗晚期实体肿瘤的早期临床数据。研究表明,抑制HPK1可激活T细胞、B细胞和树突状细胞。此次公布的数据显示,CFI-40241的安全性在临床上可控,暴露量随剂量成比例增加。31例疗效可评估的患者中,2例达到PR(目标病灶分别缩小了36%和81%),9例达到SD。Cue Biopharma公司公布了基于IL-2的先导生物制品CUE-101与PD-1抑制剂pembrolizumab联用作为一线疗法治疗患有复发性/转移性HPV+头颈部鳞状细胞癌(HNSCC)的1期临床数据。结果显示,该联合疗法的ORR为40%,临床获益率(CBR)为70%。此外,CUE-101继续显示出良好的耐受性。Ikena Oncology公司公布了IK-175单药或与PD-1抑制剂nivolumab联用治疗既往接受过免疫检查点抑制剂治疗后进展的尿路上皮癌患者的早期临床结果。IK-175通过抑制被称为芳烃受体(AHR)的癌症驱动转录因子并调节肿瘤微环境来治疗癌症。此次公布的数据显示,IK-175单药治疗的ORR为10%,DCR为20%,观察到1例确认的PR,目前缓解持续时间(DoR)达到了14.9个月,且还在持续缓解中。IK-175联用nivolumab的ORR为20%,DCR为40%。此外,IK-175的耐受性良好,具有可预测和可管理的安全性。JIN-A02”是J INTS BIO公司开发的新型第4代口服EGFR酪氨酸激酶抑制剂(TKI),具有高度的选择性,可有效对抗携带C797S双突变或三突变的非小细胞肺癌,并具有高脑渗透率和体内疗效。

来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。







{replyUser1} 回复 {replyUser2}:{content}