PNAS:王福俤与闵军霞团队合作发现巨噬细胞新型锌离子转运蛋白
11月27日,浙江大学医学院王福俤团队与闵军霞团队合作在PNAS杂志上在线发表了题为“The Metal Transporter Slc39a10 Regulates Susceptibility to Inflammatory Stimuli by Controlling Macrophage Survival”的研究论文【1】。该研究通过GEO数据库筛选及基因敲除小鼠模型,确认了金属离子转运蛋白SLC39A10(ZIP10)介导巨噬细胞锌离子摄取,并阐明了其在机体炎性状态下发挥作用的深层分子机制,为炎症及败血症等疾病的防治提供了新靶点。该成果也是在国际上通过敲除小鼠模型确认SLC39A10为首个巨噬细胞锌转运蛋白。
 微量元素锌为人体新陈代谢所必需。锌离子进出细胞以及稳态维持主要依赖于金属离子转运蛋白家族SLC39和SLC30。SLC39家族(又名ZIP家族)包含14个成员,负责离子从细胞外或细胞器运输到细胞质【2】;SLC30家族(又名ZnT家族)包含10个成员,负责离子从细胞质运输到细胞外或细胞器【3】。大量研究表明,锌离子在巨噬细胞和先天免疫中发挥十分重要的作用【4】;巨噬细胞是先天免疫反应的重要组成部分,对于维持组织器官的功能,识别清除病原体,损伤器官修复等都发挥极为重要的作用【5】。何种转运蛋白介导了巨噬细胞锌离子摄入以及调控炎症免疫调控机制存在诸多未知。
微量元素锌为人体新陈代谢所必需。锌离子进出细胞以及稳态维持主要依赖于金属离子转运蛋白家族SLC39和SLC30。SLC39家族(又名ZIP家族)包含14个成员,负责离子从细胞外或细胞器运输到细胞质【2】;SLC30家族(又名ZnT家族)包含10个成员,负责离子从细胞质运输到细胞外或细胞器【3】。大量研究表明,锌离子在巨噬细胞和先天免疫中发挥十分重要的作用【4】;巨噬细胞是先天免疫反应的重要组成部分,对于维持组织器官的功能,识别清除病原体,损伤器官修复等都发挥极为重要的作用【5】。何种转运蛋白介导了巨噬细胞锌离子摄入以及调控炎症免疫调控机制存在诸多未知。
为探明这一重要科学问题,首先在GEO数据库中找到了败血症患者基因表达数据,分析了SLC39和SLC30两大家族基因表达水平,发现存活败血症患者外周血细胞SLC39A10 mRNA水平较败血症死亡患者下调最为显著。同时,用LPS处理小鼠原代培养的巨噬细胞, Slc39a10也是显著下降。这些数据提示Slc39a10可能在巨噬细胞先天免疫中发挥作用。
为明确Slc39a10与巨噬细胞功能调控机制,团队构建了Slc39a10巨噬细胞特异敲除小鼠模型。当致死剂量LPS诱导小鼠模型是,惊奇发现敲除小鼠对炎性刺激具有抵抗,死亡率显著下降,同时肝脏的损伤和血液中炎性因子水平都显著减低;进一步实验检测,发现机体在炎性刺激下巨噬细胞数量显著减少,而这种减少是由于巨噬细胞凋亡所致【1】。
该成果的另一个亮点是阐明了Slc39a10介导锌转运并调控巨噬细胞凋亡的分子机制。在炎性状态下,Slc39a10敲除的巨噬细胞的由于缺乏锌离子,导致p53蛋白稳定性升高,从而诱发了凋亡。进一步通过Slc39a10和p53的巨噬细胞双敲小鼠验证了Slc39a10敲除小鼠巨噬细胞凋亡表型是依赖于p53蛋白的(下图)。
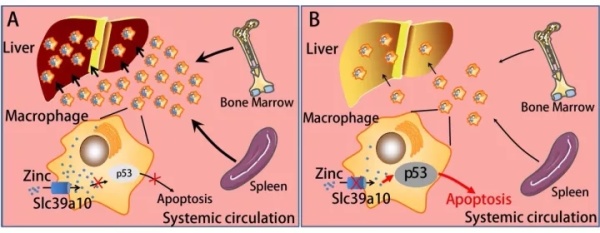 工作模式图:A为对照小鼠,B为Slc39a10巨噬细胞敲除小鼠
工作模式图:A为对照小鼠,B为Slc39a10巨噬细胞敲除小鼠
该成果研究阐明了巨噬细胞锌离子转运蛋白以及调控炎症应激下细胞凋亡精细机制,为炎症发生以及败血症等疾病防治提供了新思路。
据了解,王福俤团队长期致力于微量元素稳态代谢研究,发表百余篇研究论文。其中, SLC39和SLC30两个金属离子家族亦是团队的重要研究内容,2017年秋刚刚发表另两篇相关重要发现:
PLoS Genetics:该研究利用CRISPR/Cas9技术在斑马鱼中敲除转运膜蛋白Slc30a10(ZnT10),首次成功构建了人类高锰血症综合征疾病斑马鱼模型,并揭示转运膜蛋白ATP2C1协调维持机体锰离子稳态的分子机制【6】。
Cell Discovery:该成果是在国际上首次利用Slc39a14(Zip4)肝细胞特异性敲除及全身敲除的小鼠模型,揭示了Slc39a14在肝脏中的重要功能是介导锰离子吸收。该发现丰富了锰离子稳态代谢理论,为锰介导的中枢神经退行性疾病防治提供了重要科学依据【7】。
据悉,该研究是浙江大学医学院王福俤团队与浙江大学转化医学研究院闵军霞团队合作完成,博士研究生高虹和副教授赵璐为本文的共同第一作者;王福俤教授和闵军霞教授为本文的共同通讯作者。该研究还得到德国亚琛工业大学附属医院、中国科学院上海生命科学研究院及郑州大学合作合作支持。
 图为论文作者:左起高虹(第一作者)、王福俤、闵军霞、赵璐(共同第一作者)
图为论文作者:左起高虹(第一作者)、王福俤、闵军霞、赵璐(共同第一作者)
参考文献:
1、Hong Gao#, Lu Zhao#, Hao Wang, Enjun Xie, Xinhui Wang, Qian Wu, Yingying Yu, Xuyan He, Hongbin Ji, Lothar Rink, Junxia Min* and Fudi Wang*. The Metal Transporter Slc39a10 Regulates Susceptibility to Inflammatory Stimuli by Controlling Macrophage Survival. Proceedings of the National Academy of Sciences USA. 2017
2、Jeong J & Eide DJ (2013) The SLC39 family of zinc transporters. Molecular aspects of medicine 34(2-3):612-619.
3、Huang L & Tepaamorndech S (2013) The SLC30 family of zinc transporters - a review of current understanding of their biological and pathophysiological roles. Molecular aspects of medicine 34(2-3):548-560.
4、Prasad AS (2013) Discovery of human zinc deficiency: its impact on human health and disease. Advances in nutrition (Bethesda, Md.) 4(2):176-190.
5、Lavin Y, Mortha A, Rahman A, & Merad M (2015) Regulation of macrophage development and function in peripheral tissues. Nature reviews. Immunology 15(12):731-744.
6、Zhidan Xia#, Jiayu Wei#, Yingniang Li, Jia Wang, Wenwen Li, Kai Wang, Xiaoli Hong, Lu Zhao, Caiyong Chen, Junxia Min*, Fudi Wang*. Zebrafish slc30a10 deficiency revealed a novel compensatory mechanism of atp2c1 in maintaining manganese homeostasis. PLoS Genetics. 2017 Jul 10;13(7):e1006892. doi: 10.1371/journal.pgen.1006892
7、Yongjuan Xin#, Hong Gao#,Jia Wang#,Yuzhen Qiang, Mustapha Umar Imam, Yang Li, Jianyao Wang, Ruochen Zhang, Huizhen Zhang,Yingying Yu, Hao Wang, Haiyang Luo, Changhe Shi, Yuming Xu, Shintaro Hojyo, Toshiyuki Fukada, Junxia Min and Fudi Wang*. Manganese transporter Slc39a14 deficiency revealed its key role in maintaining manganese homeostasis in mice. Cell Discovery. 2017 Jul 18;3:17025. doi: 10.1038/celldisc.2017.25
来源:BioArt


{replyUser1} 回复 {replyUser2}:{content}