3月5款创新药有望获FDA批准
根据PDUFA的预期目标日期,预计3月,FDA将对5款创新药物的批准做出监管决定。
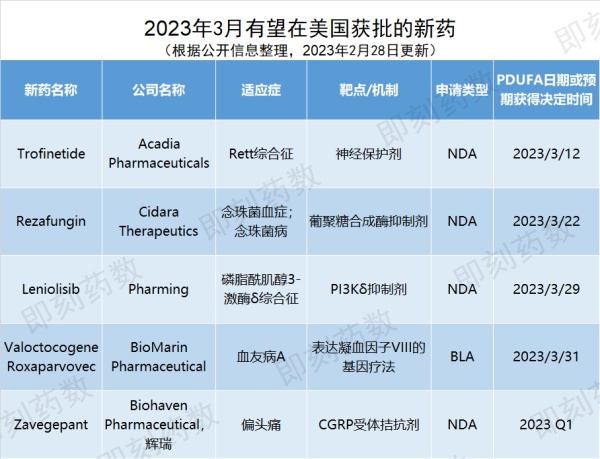
▲3月有望获FDA批准的新药(药明康德内容团队制图,点击可见大图)
药物名称:Trofinetide
公司名称:Acadia Pharmaceuticals
适应症:Rett综合征

Trofinetide是一种胰岛素样生长因子-1(IGF-1)氨基末端三肽的合成类似物,旨在通过减轻神经炎症和支持突触功能来治疗Rett综合征。研究显示,trofinetide可抑制炎性细胞因子的产生,抑制小胶质细胞和星形胶质细胞的过度活化。Trofinetide最初由Neuren Pharmaceuticals公司开发,2018年Acadia Pharmaceuticals公司获得该候选药物在北美开发和商业化的权益。
Rett综合征是一种罕见的遗传性神经发育障碍。在世界范围内大约每1万到1.5万名女性中有一名发生这种疾病。Rett综合征可导致中枢神经系统功能的严重损害,包括丧失沟通技能、出现步态异常和刻板的手部运动等症状。目前尚无FDA批准的用于治疗Rett综合征的药物。
FDA于2022年9月受理了该药物的新药申请(NDA)并授予其优先审评资格,PDUFA日期设定为2023年3月12日。这一NDA申请是基于名为Lavender的3期临床试验结果。Lavender试验结果显示,与安慰剂相比,Rett综合征行为问卷(RSBQ)总分从基线至12周的变化(p=0.0175)和临床总体印象-改善(CGI-I)量表评分(p=0.0030)在共同主要终点方面出现统计学显著改善。
药物名称:Rezafungin
公司名称:Cidara Therapeutics
适应症:念珠菌血症(candidemia)与侵袭性念珠菌病(invasive candidiasis)

Cidara Therapeutics公司开发的rezafungin是一种一周一次给药的创新棘球白素(echinocandin),用以治疗与预防严重真菌感染。文献资料显示,rezafungin通过抑制β-1,3-D-葡聚糖合成酶,进而抑制真菌细胞壁的合成从而发挥抗真菌作用。Rezafungin是由阿尼芬净衍生而来的一种带有亲脂性尾巴的环状六肽,与其它棘白菌素相比,在C5鸟氨酸位置的胆碱结构增加了其在体外和体内的稳定性。
侵袭性念珠菌病主要发生于免疫功能低下与住院患者间,是最常见的医院获得性感染之一。而念珠菌血症则是侵袭性念珠菌最常见的形式,是一种严重的血流感染,经常发生在进行大手术或使用静脉导管与某些抗生素的患者中,若不经及时治疗,通常会造成生命危险。
FDA于2022年9月接受了rezafungin的NDA申请并授予其优先审评资格,PDUFA日期设定为2023年3月22日。这一NDA申请是基于名为ReSTORE的3期临床试验与名为STRIVE的2期临床试验结果。试验结果显示,与现有必须每天进行注射的标准疗法药物caspofungin相较,一周一次给药的rezafungin达到非劣效性,达到试验主要终点。此外,rezafungin还在临床试验里检验用以在接受同种异体血液与骨髓移植的患者中,避免感染侵袭性念珠菌病的效果。
药物名称:Leniolisib
公司名称:Pharming
适应症:磷脂酰肌醇3-激酶δ综合征(APDS)

Leniolisib是一种选择性靶向PI3Kδ的口服抑制剂,具有免疫调节和潜在的抗肿瘤活性,它可以抑制磷脂酰肌醇3,4,5-三磷酸(PIP3)的产生。PI3Kẟ在调控适应性免疫系统以及先天免疫系统的众多细胞功能方面发挥着核心作用。APDS是由PIK3CD或PIK3R1突变引起的罕见原发性免疫缺陷,每百万人中大约有1至2人患上该疾病。APDS的疾病特征包括严重的复发性窦肺感染、淋巴增生、自身免疫疾病和肠病。APDS是一种进展性疾病,若延误治疗将造成永久性的肺损伤和淋巴瘤。
FDA于2022年9月受理了该药物的NDA申请并授予其优先审评资格,PDUFA日期设定为2023年3月29日。这一NDA申请是基于一项2/3期临床试验积极结果。在该试验中,受试者的病灶处淋巴结大小比基线时显著变小,这一变化具有统计学意义(P=0.006)。同时,接受leniolisib治疗后患者的免疫功能呈正常化,具体表现为幼稚B细胞的比例较基线时升高(P=0.002)。这些结果证明了leniolisib的疗效。
药物名称:Valoctocogene Roxaparvovec
公司名称:BioMarin Pharmaceutical
适应症:血友病A

BioMarin Pharmaceutical公司开发的valoctocogene roxaparvovec是一种使用AAV5病毒载体递送表达凝血因子VIII的转基因的基因疗法。它的优势在于患者可能只需要接受一次治疗,肝细胞就可以持续表达因子VIII,从而不再需要长期接受预防性凝血因子注射。血友病A以反复出血及其相关并发症为主要临床表现,其中约80%为关节出血,其并发症主要是慢性出血性关节病变。目前,血友病A的主要治疗手段是定期输注凝血因子VIII,但频繁的输注给患者的生活带来了极大不便。
FDA于2022年10月接收了关于该药物重新递交的生物制品许可申请(BLA),PDUFA日期设定为2023年3月31日。此次递交结合了BioMarin Pharmaceutical公司对之前FDA在2020年8月18日所发的完全回应信函(CRL)的回应,并包含GENEr8-1临床3期试验的2年结果,以及临床1/2期试验的5年追踪支持数据。GENEr8-1试验结果显示,valoctocogene roxaparvovec能够稳定和持久地控制出血。与入组前一年的数据相比,单次输注valoctocogene roxaparvovec后,患者的凝血因子VIII使用率和需要接受治疗的年出血率分别降低了99%和84%(p<0.001)。
药物名称:Zavegepant
公司名称:Biohaven Pharmaceutical,辉瑞
适应症:偏头痛

Zavegepant是一种高选择性的小分子CGRP受体拮抗剂。Zavegepant鼻内喷剂通过可逆性地阻断CGRP受体,从而抑制CGRP神经肽的生物活性,达到缓解与预防偏头痛发作的目的。Zavegepant最初由Biohaven Pharmaceutical公司开发,该公司在2022年被辉瑞(Pfizer)收购。偏头痛是一种以持续4-72小时严重头痛发作为特征的神经疾病,伴随的其它症状包括恶心和对声光敏感。超过10%的世界人口受到偏头痛的困扰,据统计,近40%的偏头痛患者在接受急性疗法治疗时反应不足。
FDA于2022年5月接收了该药物的NDA申请,PDUFA日期设定为2023年第1季度(Q1)。这一NDA申请是基于两项随机双盲,含安慰剂对照的关键性临床试验。试验结果显示,治疗2小时后,zavegepant组患者在无疼痛和无最烦人症状上显著优于安慰剂组,并在总计15个主要和次要终点指标上表现出统计显著优效性。并且,患者最早在接受zavegepant单次鼻内给药治疗15分钟时就显示出疼痛缓解,30分钟时患者就能恢复正常活动功能(p<0.006),疗效可持续48小时。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}