多年以后,回顾起医药产业的这段时光,会有哪些突破在历史上书写下全新的篇章?可能有人会提到改写生命蓝图的细胞与基因疗法,抑或是横空出世的RNA疗法。但在其中,一定会有新一代小分子药物的一席之地。而这一切,起源于一场偶然的安排。
上世纪末,在一场会议上,耶鲁大学的Craig Crews教授与加州理工学院的Ray Deschaies教授意外结识。原本这只是个巧合——会议组织方按姓氏字母排序,将两人的座位放在了一块。然而就是这场偶然相遇,让两位科学家成为了合作伙伴。在几轮啤酒过后,他们脑中酝酿的风暴逐渐成型:如果利用分子的特性,将致病蛋白拉到细胞的“垃圾处理中心”,就可以摧毁它们,治疗疾病。谁也没有想到。在这场酒局的25年后,这一概念演化出了无限的可能性,让产业和学术圈为新一代的小分子药物深深着迷。▲异双功能分子现已得到学术界和产业的广泛关注(数据来源:参考资料[1])
此类小分子药物的典型代表,就是PROTAC。它的一端结合目标蛋白,另一端识别泛素降解系统中的E3连接酶。通过这种机制,后者能为目标蛋白打上泛素标签,促进它们的降解。Craig Crews教授共同建立的Arvinas公司是这一领域的翘楚,其技术也已在临床试验中获得了概念上的验证。如今,生物医药产业将此类小分子药物称为“异双功能分子”,指代其两端所识别的不同对象。而将两种原本并无交集的蛋白拉到一起的方法,也被归纳在“诱导-接近”(induced-proximity)这一全新的作用机制下。科学家们逐渐意识到,它不仅能用于降解目标蛋白,还有着更多其他的用处。“有些不可成药靶点需要的不是蛋白降解,而是要稳定蛋白。”在2023年药明康德全球论坛上,加州大学伯克利分校的Dan Nomura教授如是说。在他心目中,首当其冲的应用可谓是反其道而行之——不去降解目标蛋白,反而是让它们避免被降解。▲Dan Nomura教授在2023年药明康德全球论坛上探讨解决“不可成药性”的策略
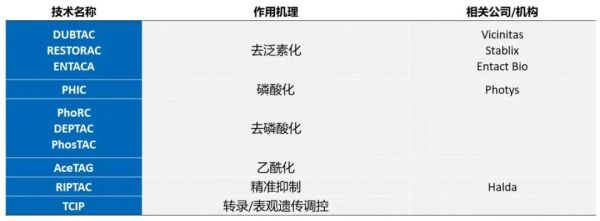
去年,Nomura教授团队与诺华生物医学研究所合作,在Nature Chemical Biology上介绍了一种名为“去泛素化酶靶向嵌合体”(DUBTACs)的全新技术。类似于PROTAC分子,DUBTAC分子一端能与目标蛋白结合,另一端则能募集去泛素化酶,去除目标蛋白表面的泛素链,防止它们的异常降解。具体来看,他们选择的去泛素化酶是OTUB1,其泛用性类似于PROTAC中使用的E3链接酶cereblon。一方面,它在各种细胞和组织表面都有表达,能作用于多种不同的蛋白质;另一方面,它的去泛素化修饰相对特异,只针对通过K48相连的泛素链(主要将蛋白送往蛋白酶体介导的降解途径)。而先进的化学生物学技术能催生全新的小分子,募集OTUB1的同时,还不影响它的活性。▲去泛素化酶靶向嵌合体的作用机理(图片来源:参考资料[6])
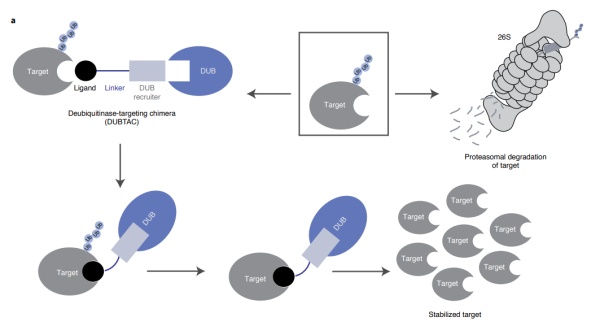
其另一端则靶向带有F508突变的CFTR蛋白。在正常情况下,CFTR扮演了氯离子通道的角色。而在发生突变时,这种蛋白会由于无法正常折叠,而被打上泛素标签,送往降解。而在DUBTAC分子的作用下,这类突变蛋白得以被稳定运输到细胞表面,行使一定的氯离子通道功能。该研究声称,此类疗法的效果要优于目前一款已上市的药物。另一个尝试则用于稳定激酶WEE1,这是一种抑癌蛋白。在很多肿瘤中,WEE1会被降解,从而促进癌细胞的增生。而细胞中的WEE1的水平,可能抑制肿瘤的生长。《自然》杂志的一篇新闻也指出,稳定抑癌蛋白的潜力不止WEE1。比如经典的抑癌蛋白p53在健康细胞内,会由于E3连接酶MDM2而保持在低水平。而一旦p53失去功能,细胞就会不受控地生长。针对p53的DUBTAC分子可能恢复其细胞水平,解决p53难以成药的困扰。同样是在去年,由Nomura教授联合成立的Vicinitas Therapeutics宣布完成6500万美元的A轮融资,以DUBTAC技术主攻遗传疾病和癌症。“DUBTAC平台有潜力靶向那些之前被认为不可成药,但对蛋白质稳定有应答的靶点。”他说道。Nomura教授也曾在药明康德全球论坛上提到,遗传疾病、癌症之外,DUBTAC技术可用于其他更为广泛的疾病领域。泛素在细胞内不止会影响蛋白稳定和降解,还会调节信号传导、蛋白相互作用、以及蛋白在细胞内的定位。而研究人员们需要做的,就是理解对不同的泛素链进行怎样的修饰,会产生怎样的结果。如果能打通其中的关键环节,针对泛素的创新技术有望在未来开辟崭新的天地。相比基因编辑,蛋白编辑听起来是一个更陌生的词。但利用异双功能的小分子,我们同样可以将修饰蛋白质的酶拉近到蛋白质附近,取得想要的“编辑效果”。比如2019年,基因泰克就曾介绍过一种叫做“磷酸酶招募嵌合体”(PhoRCs)的技术。在一篇论文中,研究人员们通过PhoRC分子,将蛋白磷酸酶PP1拉到了目标蛋白附近,成功促进了AKT和EGFR两种蛋白的去磷酸化。类似的,异双功能分子还可以促进目标蛋白的磷酸化。2020年,Broad研究所的Amit Choudhary博士与Stuart Schreiber博士两位学者带来了“磷酸化诱导嵌合体”(PHICs)技术,利用小分子拉近激酶和目标蛋白,成功让AMPK和PKC两种激酶对通常不是它们底物的目标蛋白进行了磷酸化。次年,他们又带来一款PHIC分子,使用PKC对BTK和BCR-ABL两种癌症常见蛋白进行了磷酸化。《自然》的新闻指出,这只是对蛋白进行磷酸化和去磷酸化修饰的一个开端。考虑到磷酸基团对蛋白质功能的诸多作用,这一领域未来可期。“当蛋白编辑领域成熟时,能开启许多全新的道路。”Choudhary教授补充道。由他共同创立的Photys Therapeutics公司,正在使用诱导磷酸化技术来尝试治疗癌症。以往那些难以成药的抑癌蛋白或是转录因子,都有望通过这一技术突破药物发现和瓶颈。癌症之外,PHIC技术也有望用于代谢类疾病、罕见病、以及神经疾病等领域。还有更多团队在磷酸化/去磷酸化领域耕耘。如华中科技大学王建枝教授团队开发的“去磷酸化靶向嵌合体”(DEPTAC)技术希望募集PP1,去除阿尔茨海默病相关tau蛋白上的磷酸基团。而PROTAC先驱Craig Crews教授团队则开发了“磷酸化靶向嵌合体”(PhosTAC)技术也能特异性去除tau蛋白的过度磷酸化,并且降低Tau蛋白水平,有望用于治疗阿尔茨海默病和其它Tau蛋白病。在他看来,PhosTAC分子有望取得比传统激酶抑制剂更好的效果。▲使用PhosTAC技术去除tau蛋白磷酸化的图示(图片来源:参考资料[7])
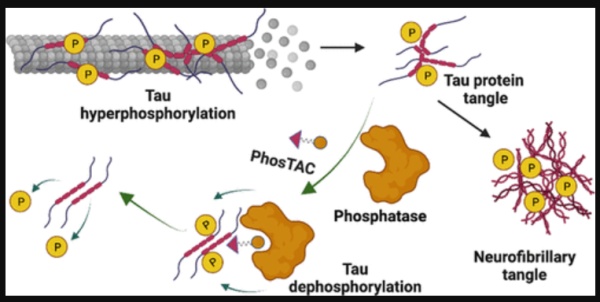
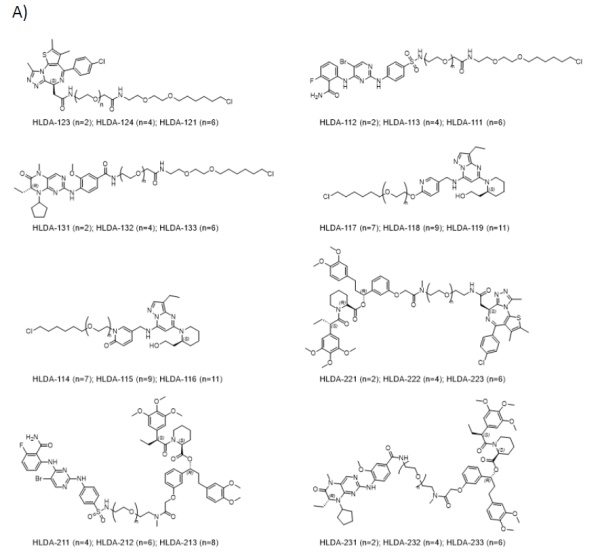
除此之外,能调整蛋白乙酰化修饰的技术(如ActTAGs),可能是“蛋白编辑”领域下一波崛起的方向。尽管这一系列创新技术让人畅想下一代小分子的未来,但很多专家也指出,这些技术目前还处于开发的早期,有不少挑战有待解决。其中的一个挑战在于如何找到能结合目标蛋白,却又不会影响其功能的结构,而计算机或许能为人类提供一臂之力。《自然》的新闻提到多伦多大学的计算化学家Matthieu Schapira教授正在寻找能结合非催化位点的配体。而利用计算机搜索的策略,他们已经在369种涉及蛋白修饰的酶里(比如去泛素酶,激酶,甲基转移酶,乙酰转移酶等),找到了超过1000个潜在的位点,这个数字之庞大让他们感到意外,也从侧面证实了这一领域未来的巨大潜力。另外一大挑战则在于如何带来组织特异性的抑制。Crews教授团队最近成立了一家名为Halda Therapeutics的公司,开发被称为“调控引导接近靶向嵌合体“(RIPTACs)的技术。简单来讲,它们就像是具有智能的抑制剂,只在目标位点发挥作用。▲RIPTAC分子的作用机制(图片来源:参考资料[8])
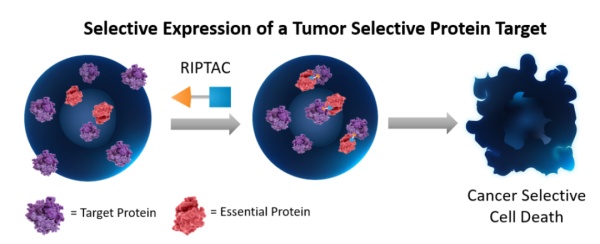
类似于PROTAC分子,RIPTAC分子的一端可以与肿瘤细胞中高度表达的蛋白相结合,而另一端则结合一些对细胞生存而言至关重要的蛋白。它们构成的复合体会抑制细胞关键蛋白的功能,导致肿瘤细胞的死亡。而健康细胞因为缺乏肿瘤细胞中高度表达的蛋白,不会被RIPTAC分子杀死。今年1月,这一技术的初步结果得到发表。“这些药物在优化后,不会对健康细胞产生强烈效应。“Halda公司的首席科学官评论道。有意思的是,在尝试解决一大挑战的同时,RIPTAC技术也带来了新的挑战。诸如PROTAC、DUBTAC、以及PHIC等技术的一大亮点,在于一个分子能反复使用,影响多个靶蛋白。然而由于其机理所限,RIPTAC分子只能一次针对一种靶蛋白。这为药物的药理学提出了新的要求。还有一些药物化学家对此类异双功能分子的尺寸提出了担忧。由于它们自带两个结合不同靶点的结构,其中还需要用连接子相连,药物的尺寸难免偏大。在代谢过程中,它们可能更容易被肝脏降解。为此,分子量更小的分子胶或许会是一种潜在的替代技术。然而从某种意义上说,过去分子胶药物的发现,多少有些运气的成分。如何理性设计分子胶,还是当下产业需要解决的一个难题。“理性设计分子胶是我们的重中之重。“Nomura教授评论道。▲不同类型RIPTAC分子的化学结构(图片来源:参考资料[8])
展望未来,倘若分子胶能实现理性设计,那它与异双功能分子之间的边界将会被进一步模糊。Nomura教授补充指出,研究异双功能分子的科学家们会进一步缩小药物的尺寸,而研究分子胶的科学家们则可能带来尺寸更大的分子,让两者更为接近。作为一名新药研发的专家,他已经迫不及待想要看到未来的发展了。






{replyUser1} 回复 {replyUser2}:{content}