近日,美国化学会(ACS)的2023春季会议中的“首次公开(First-time Disclosures)”研讨会环节落幕。此次会议的主题是“化学的十字路口”,会上多家生物医药和技术公司首次公布了在研候选疗法的化学结构,其中包括2款小分子抑制剂、1款抗体偶联药物(ADC)、以及1款蛋白降解剂。这些分子所针对的是久经考验的“老”靶点,但它们在作用机制、疗效、或是解决“不可成药”挑战等方面有着独特的优势,使其有别于现有的同类药物。在今天的文章中,药明康德内容团队将结合猎药人网站(drughunter.com)和其他公开资料向读者介绍这些新分子结构所对应的候选疗法。
▲MK-0616结构式(图片来源:参考资料[1])
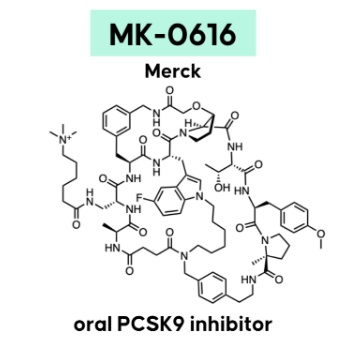
高胆固醇血症是一种与心脏病、中风和其他健康问题相关的高风险因素,血液中胆固醇的过度积累会导致血管中斑块的形成和积累,最终造成动脉硬化和狭窄(动脉粥样硬化)。前蛋白转化酶枯草溶菌素9(PCSK9)是一种在调节血液中胆固醇水平方面发挥着关键作用的蛋白,通过与肝细胞表面的低密度脂蛋白(LDL)受体结合促进LDL受体的溶酶体降解,导致低密度脂蛋白胆固醇(LDL-C)的清除率减少。研究发现,抑制PCSK9可以有效降低体内LDL-C的水平进而达到治疗疾病目的,使其成为高胆固醇血症的新兴治疗靶点。全球范围内已经有多款靶向PCSK9的创新疗法获批,包括靶向PCSK9的单抗以及siRNA疗法等。由于LDL受体和PCSK9蛋白相互结合的界面很大,利用小分子药物扰乱它们之间的相互作用非常困难。默沙东开发的MK-0616是一种分子量在1000-2000之间的大环多肽化合物,它的分子量比传统的小分子要更大一些,具有扰乱LDL受体和PCSK9蛋白结合的能力。同时,为了克服因分子量过大所导致的细胞膜穿透能力下降,科学家们使用了被称为“渗透增强剂”的脂质分子,以帮助化合物从肠道进入血液循环。
MK-0616可以通过口服给药,在临床试验中,接受8周不同剂量(6 mg~30 mg)MK-0616治疗后,高胆固醇血症患者的LDL-C水平显著低于安慰剂治疗的患者。降低幅度在41.2%(6 mg)到60.9%(30 mg)。患者在服药两周后疗效就接近峰值,并且在为期8周的治疗中得到维持。默沙东表示将持续推进这一项目的研发,并预期在今年下半年推进3期临床开发。▲NX-2127结构式(图片来源:参考资料[1])
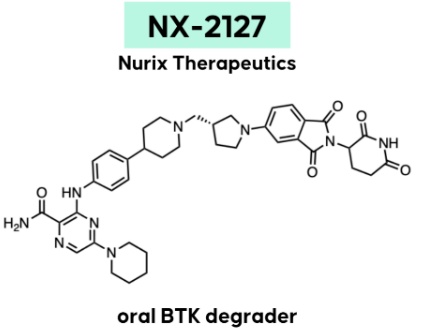
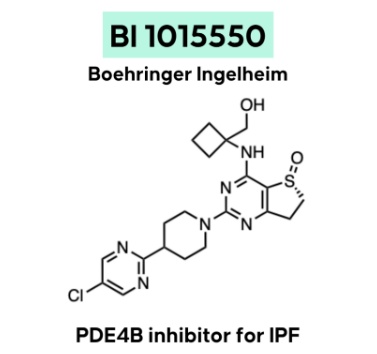
NX-2127是一款具有双重活性的口服小分子靶向蛋白降解剂,其靶点为布鲁顿氏酪氨酸激酶(BTK)蛋白。NX-2127不但具有降解BTK的活性,而且拥有免疫调节药物的特性。BTK参与调控B细胞抗原受体信号通路,其异常激活与白血病和淋巴瘤有关,在慢性淋巴细胞癌中,癌细胞内的BTK蛋白水平往往出现异常升高。BTK作为B细胞血液癌治疗靶点的有效性已在临床上得到了验证,目前有多款BTK抑制剂获批上市。然而,部分癌症患者经过一段时间的治疗后,会对BTK抑制剂产生耐药性,这些患者往往治疗选择有限,由此引发对新一代疗法的未竟需求。NX-2127的作用机制与其他小分子抑制剂不同。在与BTK结合的同时,NX-2127募集E3泛素连接酶,给BTK蛋白加上泛素“标签”,让它们被细胞的蛋白酶体降解。这种作用机制导致它不需要与影响蛋白活性的位点紧密结合就可以发挥作用,不但有望解决对传统小分子抑制剂的耐药性,还具有克服“不可成药”难题的潜力。在1期临床试验中,NX-2127不但强力而且持久地降解BTK,而且让多名患者获得有意义的临床获益,在携带BTK耐药性突变的患者中也观察到部分缓解。研发机构:勃林格殷格翰(Boehringer Ingelheim)▲BI 1015550结构式(图片来源:参考资料[1])
特发性肺纤维化(IPF)是进展性纤维化性间质性肺疾病中较常见的一种类型,其症状包括活动时呼吸困难、持续性干咳、胸闷、疲劳和虚弱。肺纤维化指肺组织的不可逆疤痕形成,对肺功能和生活质量产生负面影响,并可能危及生命。BI 1015550是一款在研口服PDE4B抑制剂,结合了抗纤维化和抗炎的双重作用,有望治疗肺纤维化和进行性纤维化性间质性肺疾病相关炎症。美国FDA曾在2022年授予BI 1015550突破性疗法认定,用于治疗IPF。PDE4是磷酸二酯酶(PDE)家族的一员,包含4个亚型(PDE4A-PDE4D),可通过特异性水解cAMP而调控促炎、抗炎细胞因子的产生,从而发挥一系列作用。研究发现,抑制PDE4的活性可以使细胞内cAMP水平升高,激活蛋白激酶A(PKA),从而抑制NFκB和NFAT等信号通路而减少下游细胞因子和趋化因子的释放,因此以PDE4为靶点的疗法有望治疗多种炎症相关疾病。
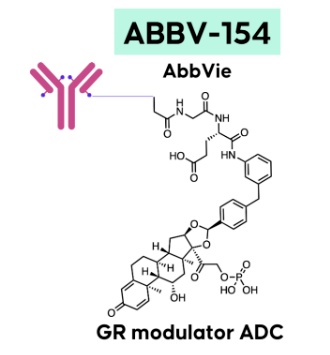
其中,PDE4B在控制钙诱导的钙释放过程方面发挥作用,优先抑制PDE4B可维持治疗肺纤维化的疗效,同时避免某些不良事件。然而,PDE4的4种亚型的活性位点具有高度相似性,大多数PDE4抑制剂无法区分不同亚型。而勃林格殷格翰的这款抑制剂在靶点选择性上有着显著优势——它对于PDE4B具有优先的酶促抑制作用。2期临床研究数据显示,服用BI 1015550的患者在第12周时的用力肺活量FVC相比基线时显示出轻微改善,而安慰剂组的患者这一指标出现下降。此外,该疗法的安全性和耐受性良好,这些数据支持了勃林格殷格翰将该药物推进至3期临床研究的计划,以进一步研究BI 1015550改善特发性肺纤维化和其他类型进展性肺纤维化患者肺功能的疗效。疾病领域:风湿性多肌痛、克罗恩病(Crohn's Disease)▲ABBV-154结构式(图片来源:参考资料[1])
ABBV-154是艾伯维旗下一款在研抗体偶联药物(ADC),旨在治疗风湿性多肌痛和克罗恩病。ABBV-154由靶向肿瘤坏死因子α(TNFα)的阿达木单抗和新型糖皮质激素受体调节剂组成,通过将糖皮质激素受体调节剂直接递送到表达TNFα的活化免疫细胞中,以调节TNF介导的炎症相关通路、降低机体炎症水平。糖皮质激素作为一种基础的治疗方案,具有广谱的抗炎、免疫抑制、抗毒和抗休克等作用,被广泛的使用于各种自身免疫性疾病的治疗中。然而,这类药物伴随药理作用而来的不良反应往往难以避免。ABBV-154通过TNFα抗体进行糖皮质激素药物的精准递送,在显著抑制炎症的同时可以最大限度地减少与糖皮质激素相关的全身副作用,实现免疫平衡的精准调节,因此有望成为更加高效、安全、低毒副作用的自身免疫疾病治疗方法。当前ABBV-154正处于2期临床研究阶段。总言之,虽然此次发布的药物分子都是基于既定的靶点,但其在作用机制和疗效方面的独特优势使其有别于以往的药物,有望成为一种全新、有效的治疗选择,尤其是对于那些治疗选择有限的患者。随着业界继续探索这些新型分子的全部潜力,我们期待在未来见证相关在研疗法取得更多突破。





{replyUser1} 回复 {replyUser2}:{content}