治疗阿尔茨海默病的免疫疗法;潜在“first-in-class”渐冻症反义寡核苷酸疗法... | 一周盘点
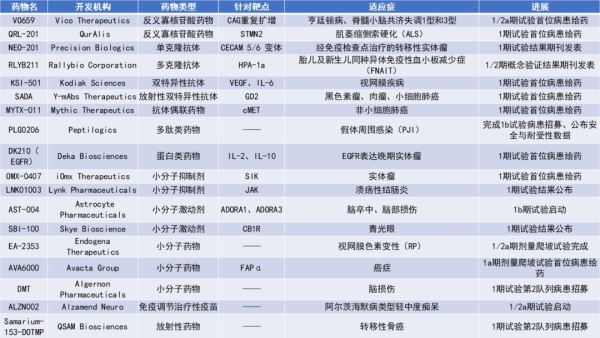
1. Alzamend Neuro公司宣布启动免疫治疗疫苗ALZN002的1/2a期临床试验,用于治疗轻中度阿尔茨海默病。
ALZN002:1/2a期试验启动

Alzamend Neuro公司宣布启动免疫治疗疫苗ALZN002的1/2a期临床试验,用于治疗轻中度阿尔茨海默病。该临床试验主要目的为确定2b期临床试验中所使用ALZN002的适当剂量。
ALZN002是一种专有的“主动”免疫治疗产品,意味着它是由每个患者的免疫系统产生的。它由自体树突状细胞(DCs)组成,这些DCs是从每个患者的血液中分离出激活的白细胞,然后在体外改造成攻击阿尔茨海默病相关淀粉样蛋白的细胞。它们旨在增强患者的免疫系统对抗阿尔茨海默病的能力。在增加治疗安全性与耐受性同时,刺激免疫系统减少脑中β淀粉样蛋白的负担,从而减轻阿尔茨海默症状。
与使用外来血液制品(如单克隆抗体)的被动免疫治疗方法相比,使用ALZN002的主动免疫治疗可能在淀粉样蛋白清除方面产生更强大和持久的效果,以及频率较少的治疗次数。
QRL-201:1期试验首位病患给药

ALS是一种严重的神经退行性疾病,治疗选择有限。STMN2对神经修复和轴突稳定非常重要,其表达在几乎所有ALS患者中都显著降低。STMN2又称SCG-10,是稳定微管的蛋白质,微管是细胞和轴突细胞骨架的重要组成部分。STMN2在人类运动神经元中高度表达,这些神经元是ALS患者主要退化的细胞。在动物模型中,STMN2缺失导致轴突退化和肌肉内神经支配的丧失,这是导致ALS患者瘫痪的主要功能缺陷。
在来自ALS患者的人类神经干细胞模型中,研究人员发现STMN2的表达受TDP-43的调控。此外,正常TDP-43功能的丧失会导致STMN2表达显著下降,并导致神经修复能力受损,通过恢复STMN2水平可拯救这种功能缺陷。这些研究结果已发表在《自然神经科学》上。
SB-121:1b期试验结果期刊发表

自闭症谱系障碍(ASD)是一种神经发育性障碍,其核心障碍为社交沟通和互动的受损,同时伴随着行为和/或兴趣的限制性、重复性模式。
这项人体1期试验是一项双盲、安慰剂对照的交叉研究,旨在评估SB-121的安全性和耐受性。SB-121是一种新型口服Lactobacillus reuteri(Lr)制剂,用以治疗确诊ASD的15至45岁的患者。Lr是一种常在母乳中发现的细菌。试验结果显示SB-121具良好的安全性和耐受性。该结果还观察到患者治疗相关Vineland-3自适应行为评估的改善、眼球追踪的测量和外周催产素水平的增加。催产素是一种天然荷尔蒙,除了许多其他功能外,还可以促进结合和社交互动。
VO659:1/2a期试验首位病患给药
Vico Therapeutics宣布,VO659的1/2a期临床试验已完成首名患者给药。这项研究使用VO659治疗亨廷顿病(HD)、1型脊髓小脑性共济失调(SCA1)和3型脊髓小脑性共济失调(SCA3)。VO659是一种反义寡核苷酸(ASO)在研药物,旨在靶向导致包括HD、SCA1和SCA3在内的所有已知多谷氨酸疾病的CAG重复扩增。
新闻稿指出,VO659是首个靶向导致这些疾病的CAG重复扩增的临床候选药物。VO659的设计旨在优先降低突变的HTT基因并保护野生型HTT基因。VO659的独特靶标和双重作用机制使其能够在多种疾病模型中实现强大的靶向作用。在HD的疾病小鼠模型中,临床前研究观察到mHTT蛋白的显著、剂量依赖性降低和运动功能改善。在HD患者细胞模型中,亦观察到优先降低编码mHTT的等位基因表达。此外,VO659在SCA1和SCA3的疾病小鼠模型和患者细胞模型中均能够显著降低突变ATXN1(mATXN1)和突变ATXN3(mATXN3)蛋白的水平。
基于NEO-201良好的安全性和活性,2期试验病患正在招募当中,包含那些已接受过检查点抑制剂治疗的转移性非小细胞肺癌(NSCLC)、头颈癌、子宫内膜癌和宫颈癌患者。过去研究结果显示,它能够杀死表达其靶点的癌细胞。在1期临床试验中,发现NEO-201能够减少难治性实体肿瘤患者的免疫抑制细胞数量,这些细胞可能削弱检查点抑制剂的癌细胞杀伤活性。正在进行的2期试验旨在测试NEO-201与Keytruda联合使用时是否能够提高检查点抑制剂的有效性。
RLYB211:1/2期概念验证结果发表
Rallybio公司宣布,其用于预防胎儿及新生儿同种异体免疫性血小板减少症(FNAIT)的在研抗体RLYB211临床1/2期试验的概念证明研究结果发表在国际血栓与止血学会官方期刊Journal of Thrombosis and Haemostasis上。FNAIT是一种罕见且危及生命的出血性疾病,是因母体免疫球蛋白靶向胎儿血小板而导致严重的胎儿/新生儿不良事件,目前尚无批准治疗FNAIT的方法。
RLYB211为靶向HPA-1a的人源性多克隆抗体。这项随机单盲、安慰剂对照的试验检视了静脉单次注射RLYB211对于消除健康受试者体内HPA-1a阳性血小板的能力,这些受试者为HPA-1a阴性,是经由输注后体内带有HPA-1a阳性血小板。在队列1中,受试者在输注HPA-1a阳性血小板1小时后接受RLYB211或安慰剂治疗,而在队列1B中,受试者则是在接受RLYB211或安慰剂治疗后一周接受血小板输注。结果显示,RLYB211加速HPA-1a阳性血小板的清除,与安慰剂组相比,所有接受RLYB211治疗的受试者符合血小板清除半衰期超过90%下降的概念验证标准。在RLYB211给药7天后,血小板的快速清除效果亦明显,此试验设计是用以模拟在胎儿出血之前预防性给予抗HPA-1a抗体的状况。此外,RLYB211耐受性良好,未报告任何严重不良事件。
KSI-501:1期试验首位病患给药
Kodiak Sciences公司宣布首位患者接受了在研双特异性抗体KSI-501的1期试验治疗。KSI-501是一种新型的双特异性抗体生物聚合物结合物,同时靶向VEGF和IL-6。这项1期试验是一项开放标签的多剂量递增研究,最初招募的患者患有糖尿病黄斑水肿(DME)。试验主要目的是评估药物对眼部和全身的安全性,并确定最大耐受剂量。在临床前细胞实验中,KSI-501可抑制血管生成,同时正常化内外眼底血管屏障;与单一抗VEGF或抗IL-6抗体相比,KSI-501双重抑制VEGF和IL-6能显著改善细胞形态和细胞间连接的正常化。
MYTX-011:1期试验首位病患给药
Mythic Therapeutics宣布完成其在研抗体偶联药物(ADC)MYTX-011在1期临床试验KisMET-01的首位患者给药。MYTX-011正被检视用于治疗局部晚期、复发或转移性NSCLC患者的疗效与安全性。
MYTX-011是通过Mythic创新的FateControl技术平台所开发的cMET靶向ADC,此技术可使得ADC主动导航到细胞内,从而可能增加抗癌药物对肿瘤细胞的输送,并降低对健康细胞的影响。
LNK01003:1期试验结果公布
Lynk Pharmaceuticals宣布其自主研发的创新肠道限制性JAK抑制剂LNK01003已完成在中国健康受试者的1期试验。该研究结果显示,该药物具有良好的安全性、耐受性和药代动力学性能。
LNK01003是一种口服小分子JAK抑制剂,具有肠道限制性特性,开发用于治疗溃疡性结肠炎和相关疾病。通过将药物暴露限制在胃肠道,加上高系统清除,可以避免药物因全身免疫抑制引起的副作用。由于该药物在胃肠组织中的浓度较高,它可以最大限度地抑制多种在炎症性肠病中发挥作用的炎性细胞因子。因此,LNK01003具有提高治疗效果的潜力。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}