月初,Vertex和CRISPR Therapeutics公司宣布已经完成向FDA提交其共同开发CRISPR基因编辑疗法exagamglogene autotemcel(exa-cel)的滚动生物制品许可申请(BLA)。
这个月初,Vertex和CRISPR Therapeutics公司宣布已经完成向FDA提交其共同开发CRISPR基因编辑疗法exagamglogene autotemcel(exa-cel)的滚动生物制品许可申请(BLA),用于治疗镰刀状细胞贫血病(SCD)和输血依赖性β地中海贫血(TDT)患者。FDA预计将在8-12个月后公布审评结果。同时,公司也已向欧盟与英国递交上市申请。这是一个历史性的时刻——如果获批,这将可能是世界上第一个上市的CRISPR基因编辑疗法。

CRISPR是一项在10年前才开发出来的基因编辑方法,然而其飞快的进展已使不少临床患者从中获益。“这是令人兴奋的!虽然编辑基因组的能力是一种强大的工具,但我认为我们当中没有人能想象领域会发展得如此迅速。”在2020年因其在CRISPR领域开创性的工作而获得诺贝尔奖殊荣的Jennifer Doudna博士表示。
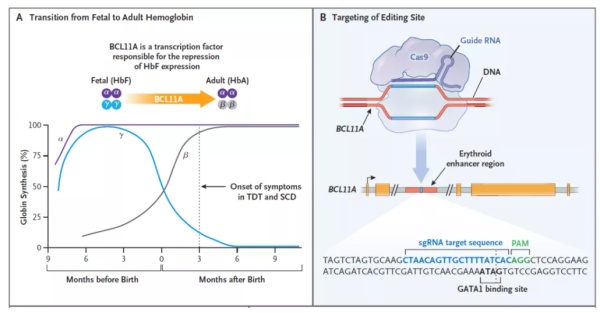
β-地中海贫血症与镰刀状细胞贫血病都是因为β珠蛋白基因突变所造成患者贫血的现象。在β-地中海贫血症中,由于基因突变,患者的血红蛋白缺乏,使得其红细胞几乎没有携带氧气的能力。而在镰刀状细胞贫血病中,则是因血红蛋白突变导致红细胞镰状化和聚集,进而引发疼痛的炎症性血管闭塞性危象(VOC),并造成溶血。红细胞的破裂会导致贫血和慢性器官损伤。治疗β-地中海贫血症的方法包括输血,在严重病例中,可能每个月都需要输血。对于镰刀状细胞贫血病,现有的小分子药物可以减少疼痛、发病率和死亡率,但无法完全治愈这些病症。▲Exa-cel的作用机制:A,BCL11A是下调胎儿血红蛋白表达的转录因子;B,exa-cel通过对BCL11A进行基因编辑,上调胎儿血红蛋白的表达(图片来源:参考资料[4])Exa-cel(曾用名:CTX001)是一款非病毒性载体的自体细胞疗法。研究人员从患者体内收集的造血干细胞及祖细胞(HSPCs)后,通过CRISPR/Cas9核酸酶的精确DNA切割能力,对胎儿血红蛋白基因的抑制因子BCL11A进行编辑,进而启动胎儿血红蛋白的转录。胎儿血红蛋白通常在婴孩出生后的几个月内自然停止表达,但通过重新激活该基因,其产物可弥补两种贫血患者中缺陷β-珠蛋白的携氧能力,缓解输血需求,达到潜在治愈的效果。在临床试验中,exa-cel展现了出色的治疗效果。去年,Vertex和CRISPR Therapeutics在欧洲血液学会(EHA)大会上报告了两个正在进行的1/2/3期试验中75名患者的最新数据。接受exa-cel治疗的44名重度地中海贫血患者中的42位,在平均随访12.3个月期间不再需要依赖输血。同时,它也预防所有31名镰刀状细胞性贫血患者产生血管闭塞性危象(平均随访9.6个月)。在接受治疗前的两年里,这些镰状细胞病患者平均每年经历约4次的危象。此外,exa-cel疗法还将患者的胎儿血红蛋白平均比例提高到40%,并将平均血红蛋白水平提高到11 g/dL以上。CRISPR Therapeutics的首席执行官Samarth Kulkarni博士表示:“这显示CRISPR的强大力量—— 具有在基因水平上精确治疗并带来治愈方法的能力。”▲维多利亚·格雷女士在人类基因组编辑国际峰会上演讲(Courtesy THE ROYAL SOCIETY;图片来源:参考资料[5])今年3月,在第三届人类基因组编辑国际峰会上,首位接受exa-cel疗法的镰状细胞贫血病患者维多利亚·格雷(Victoria Gray)女士分享了她的经历。在接受治疗近一年后,她血液中约46%的血红蛋白仍然是胎儿血红蛋白,并且在99.7%的红细胞中携带这种蛋白。此外,维多利亚的骨髓细胞活检显示,超过81%的细胞含有产生胎儿血红蛋白所需的遗传变化,这表示基因编辑过的细胞在她的体内持续存活和运作着。自从维多利亚接受移植以来,她不再需要接受输血治疗,疼痛情形也消失了。由于exa-cel是潜在首个获批的CRISPR疗法,它的安全性是监管人员在审评中的主要考量因素。试验结果显示,在75名接受治疗的患者中,有2例出现严重不良事件(SAEs),包括血小板减少症和造血淋巴组织细胞吞噬细胞性综合症。这些SAEs被认为与exa-cel疗法和在接受疗法前所进行的化疗方案有关,但均已获得解决。CRISPR进行基因编辑的机制使其在治疗应用上存有潜在风险。Cas核酸酶在沉默基因的过程中会在DNA上制造双链断裂,然后通过细胞中的机制将错误修复。然而,在体外进行这个过程则可能导致大的基因组重排和易位,并产生一种称为染色体碎裂(chromothripsis)的现象,导致靶向染色体完全丢失。直至目前为止,这些现象尚未在接受治疗的患者中发现,且在患者接受细胞重新输注入体内前,受影响的细胞可能已经死亡。但产生这些编辑事件的可能仍引发部分人士对于疗法致癌和其他严重风险的担忧。另一个潜在风险则是CRISPR系统中指导RNA(guide RNA)可能引导Cas核酸酶切割序列类似的非靶点位点,从而导致非靶向编辑。然而,通过进行深度测序(deep sequencing)筛选出可能与指导RNA匹配的基因组位点,并选择更具专一性的Cas核酸酶,研究人员在预测和减轻这些风险上取得良好的进展。这种第一代CRISPR疗法的局限性也促使科学家们不断研究、改善现有的基因编辑方法。例如目前尚处早期开发阶段的碱基编辑(base editing)和先导编辑(prime editing)则仅对基因进行单一碱基的置换,避免DNA双链断裂的产生。“然而在许多情况下,我们并不想破坏致病基因。相反,我们需要精确修复导致遗传疾病的突变。”全球基因编辑领域的顶尖学者刘如谦(David Liu)博士在2020年的药明康德全球论坛中表示,世界上有数百种疾病,要治疗它们,只需要把基因恢复到野生型的状态,没有必要去做基因敲除。此外,开发治疗其他器官、细胞遗传性疾病的体内基因编辑疗法也是产业目前跃跃欲试的方向。体内基因编辑疗法是将基因编辑器直接递送至患者体内,因而不需经过患者细胞离体培养、扩增等繁复过程。而肝脏是开发这一类疗法的起点,因为通过静脉输送的药物容易输送至肝脏。例如,Intellia Therapeutics的CRISPR-Cas9候选药物NTLA-2001和NTLA-2002分别用于编辑肝细胞,以治疗甲状腺素转运蛋白淀粉病和遗传性血管水肿。去年,Verve公司将其PCSK9碱基编辑项目推进到临床阶段,针对肝细胞进行心血管疾病的治疗。此外,Vertex和CRISPR Therapeutics还共同开发了一种针对杜氏肌营养不良症(DMD)的肌肉靶向基因编辑疗法。他们的临床前项目采用腺相关病毒(AAV)载体方法,将肌肉细胞中突变的肌球蛋白基因的一个小片段剪掉,重新对齐基因的读框(reading frame),进而使得细胞生产几乎全长的肌球蛋白。CRISPR Therapeutics还与Capsida公司合作,开发针对中枢神经系统的CRISPR–Cas药物。随着基因编辑疗法的蓬勃发展,让我们期待除了在数月后可能见证首个CRISPR疗法获批之外,有更多靶向不同疾病类别、更加安全有效的疗法获得开发,造福更多的患者。




{replyUser1} 回复 {replyUser2}:{content}