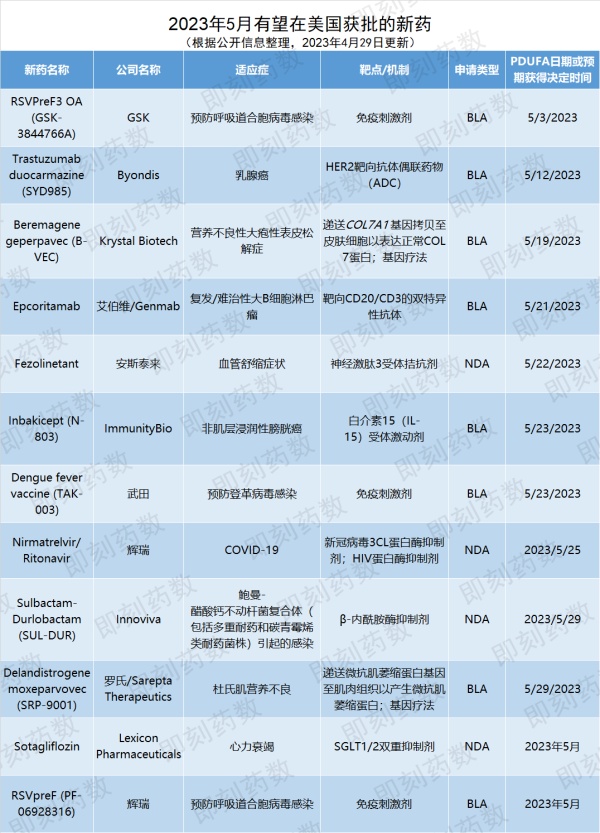
根据PDUFA的预期目标日期,预计5月,美国FDA将对12款创新药物或疫苗的批准做出监管决定,本文将精选其中6款进行相关介绍。
▲5月有望在美国获批的新药(药明康德内容团队制图,点击可见大图)GSK公司开发的RSVPreF3 OA是针对老年人的RSV疫苗,是由RSV融合前(prefusion)F糖蛋白(RSVPreF3)与GSK专有的佐剂组合而成。此融合前F糖蛋白为RSV病毒进入人体细胞所需。RSV是一种常见的传染性病毒,主要影响肺部和呼吸道。当感染RSV后,老年人群患严重疾病的风险很高,部分原因是与年龄相关的免疫力下降,其中有基础疾病(如呼吸系统和心脏疾病,以及糖尿病)的老年人患上严重疾病的风险更大。每年在全球,RSV导致超过33.6万老年人住院和1.4万人死亡。目前世界上还没有RSV疫苗获得批准。FDA于2022年11月受理了该药物的生物制品许可申请(BLA)并授予其优先审评资格,PDUFA日期设定为今年5月3日。这一BLA申请是基于名为AReSVi-006的3期临床试验结果。数据显示,该试验达到主要终点,此RSV疫苗具有高达82.6%(96.95% CI:57.9-94.1)的效力,可协助参与者避免RSV引起的下呼吸道疾病(LRTD)。其他预定的次要终点的分析结果亦与此一致。今年3月,该款RSV疫苗还获得FDA的疫苗与相关生物制品产品咨询委员会(VRBPAC)支持,用于预防60岁及以上成人因RSV引起的LRTD。药物名称:Trastuzumab duocarmazineByondis公司开发的trastuzumab duocarmazine是一款靶向HER2的抗体偶联药物(ADC)。它的抗体部分能够与癌细胞表面的HER2靶向结合,导致ADC被细胞内化。这款ADC的有效载荷在与抗体偶联的时候处于失活状态,在连接子被水解切割后,失活的细胞毒素药物vc-seco-DUBA被激活,从而诱导DNA损伤导致肿瘤细胞死亡。乳腺癌是女性癌症死亡的主要原因,估计2020年全球有230万新增病例。约20%的乳腺癌为HER2阳性,在HER2阳性乳腺癌中,HER2蛋白的过度表达导致乳腺细胞的繁殖失控,与HER2阴性患者相比,疾病侵袭性更强,复发可能性更大,预后更差。FDA于2022年7月受理了该药物的BLA申请,PDUFA日期设定为今年5月12日。此前,该药物于2018年1月被美国FDA授予治疗转移性HER2阳性乳腺癌的快速通道资格。这一BLA申请是基于名为TULIP的关键3期临床试验结果。该药物在TULIP试验中达到了无进展生存期(PFS)的主要终点,与医生选择(PC)的疗法相比可显著改善HER2阳性不可切除的局部晚期或转移性乳腺癌患者的PFS,trastuzumab duocarmazine组PFS为7.0个月,医生选择的疗法组PFS为4.9个月。此外,接受trastuzumab duocarmazine组的总生存期(OS)呈改善趋势。药物名称:Beremagene geperpavecKrystal Biotech公司开发的beremagene geperpavec是一款非侵入性、可局部使用并重复给药的基因疗法。此疗法通过为患者的皮肤细胞提供制造正常VII型胶原蛋白(COL7)的模板,在分子水平上治疗DEB。DEB是一种罕见且严重的单基因慢性遗传疾病,由编码COL7的COL7A1基因出现突变引起,使皮肤缺少胶原蛋白,从而导致表皮与真皮分离。患者的皮肤和粘膜组织极度脆弱,轻微摩擦或创伤都会引起水疱和撕裂,开放性伤口会导致皮肤感染和纤维化,可能使手指和脚趾融合,并最终增加发生鳞状细胞癌的风险,严重时可能致命。目前尚无获批疗法。FDA于2022年8月受理了该药物的BLA申请并授予其优先审评资格,PDUFA日期设定为今年2月17日,后推迟至今年5月19日。这一BLA申请是基于名为GEM-3与GEM-1/2的两项试验结果。其中关键性GEM-3临床试验达到其主要终点,在31例DEB患者中,在治疗3个月时,与安慰剂相比(20%),71%接受beremagene geperpavec治疗的患者伤口完全愈合(p<0.005)。在治疗6个月时,与安慰剂相比(22%),67%接受beremagene geperpavec治疗的患者伤口完全愈合(p<0.005)。这项研究的相关结果发表在医学期刊《新英格兰医学杂志》。参考阅读:皮肤一碰就破,到处都是伤口... 这些患者有望迎来首款基因疗法适应症:复发/难治性大B细胞淋巴瘤(r/r LBCL)艾伯维和Genmab公司联合开发的epcoritamab是一种皮下给药的CD20/CD3双特异性抗体,epcoritamab能够同时靶向T细胞上的CD3蛋白与B细胞上的CD20蛋白,进而引发T细胞介导毒杀CD20阳性细胞。CD20在B细胞上表达,是许多B细胞恶性肿瘤,如弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)等的经验证靶标。大B细胞淋巴瘤(LBCL)是一种难于治疗的侵袭性血液癌症,大约40%的患者在接受首次治疗后出现复发或难治性疾病。据估计,每年全球约有15万新确诊LBCL患者。FDA于2022年11月接收了epcoritamab的BLA申请并授予其优先审评资格,PDUFA日期设定为2023年5月21日。这一BLA申请是基于名为EPCORE NHL-1的1/2期临床试验结果。该研究队列包括157名之前接受过中位三线治疗的复发或难治性LBCL患者,总缓解率(ORR)为63%,完全缓解率(CR)为39%。新闻稿指出,若获批,epcoritamab将成为首个用于治疗LBCL的皮下给药双特异性抗体。该药也于今年年初获Evaluate收录至2023年有望获批的十大潜在重磅疗法。药物名称:Delandistrogene moxeparvovec公司名称:罗氏(Roche)/Sarepta Therapeutics罗氏与Sarepta Therapeutics公司联合开发的delandistrogene moxeparvovec是一种基因疗法,旨在将编码微抗肌萎缩蛋白(micro-dystrophin)的基因递送到肌肉组织以产生抗肌萎缩蛋白(dystrophin)的主要成分。DMD是一项罕见的X-染色体连锁遗传疾病,是由于在X染色体上编码抗肌萎缩蛋白的基因出现突变而导致,因此几乎只影响男性患者,是最常见的儿童神经肌肉疾病之一,在全球每3500-5000个出生的男孩有1位会罹患DMD。DMD疾病进展的里程碑包含患者丧失步行与进食能力,以及需要呼吸辅助与心肌疾病的产生,患者的预期寿命通常不超过40岁。FDA于2022年11月受理了该药物的BLA申请并授予其优先审评资格,PDUFA日期设定为2023年5月29日。此前,delandistrogene moxeparvovec获得FDA授予快速通道资格、孤儿药资格与罕见儿科疾病(RPD)认定。这一BLA申请是基于在临床前研究、生物标志物研究和临床功能研究所取得的积极结果。在临床试验中,SRP-9001治疗在多个时间点显示出积极的结果,包括在治疗后一年、两年和四年,此外还表现出了一致的安全性。辉瑞公司开发的RSVpreF是一款拟针对老年人和婴儿的RSV疫苗。该RSV疫苗根据美国国立卫生研究院(NIH)所建立的RSV融合前F蛋白晶体结构所制造。此融合前蛋白为RSV病毒用以进入人体细胞的F蛋白的主要形态。NIH的研究显示靶向此融合前蛋白形态可以有效阻断病毒感染。RSV是一种传染性病毒,也是呼吸道疾病的常见原因。该病毒感染发生在所有年龄段的人群中,对于大多数年轻人来说,症状可能像普通感冒,但对于婴儿、免疫功能低下者和老年人来说,出现严重疾病的风险更高,可能危及生命。仅在美国的老年群体中,RSV感染造成了每年约6万-12万人次住院治疗、6000-14000人死亡。目前世界上还没有RSV疫苗获得批准。FDA于2022年12月受理了该药物的BLA申请并授予其优先审评资格,PDUFA日期设定为2023年5月。这一BLA申请是基于名为RENOIR的3期临床试验结果支持,RENOIR的中期疗效分析数据显示该RSV疫苗保护力达66.7%(96.6% CI:28.8-85.8),并且耐受性良好。今年2月,FDA再次授予RSVpreF优先审评资格,通过怀孕妇女产生主动免疫,进而预防自出生起至六个月大的婴儿出现RSV引起的下呼吸道疾病。今年3月,该款RSV疫苗还获得FDA的疫苗与相关生物制品产品咨询委员会支持,用于预防60岁及以上成人由RSV引起的急性呼吸道疾病和下呼吸道疾病。








{replyUser1} 回复 {replyUser2}:{content}