科学家们已经将目标转向其它KRAS突变体,旨在开发出能够靶向多种、甚至全部KRAS突变体的泛KRAS(pan-KRAS)靶向疗法,为携带KRAS突变的诸多癌症类型提供治疗选择。
KRAS是最早发现的癌症基因之一,其突变在癌症患者中很常见。但在很长一段时间里,致癌性的KRAS蛋白被认为是靶向治疗的“不可成药”靶点。这种情况随着KRAS G12C抑制剂Lumakras(sotorasib)与Krazati(adagrasib)的获批开始发生改变。
但G12C只是KRAS的众多突变形式之一,而sotorasib与adagrasib的适应症肺癌也不过是与这些致癌突变相关的众多癌症之一。在发现KRAS G12C抑制剂之后,科学家们已经将目标转向其它KRAS突变体,旨在开发出能够靶向多种、甚至全部KRAS突变体的泛KRAS(pan-KRAS)靶向疗法,为携带KRAS突变的诸多癌症类型提供治疗选择。近日发表在《自然》杂志上的一篇论文中,美国纪念斯隆-凯特琳癌症中心(Memorial Sloan Kettering Cancer Center)的研究人员发布了一种新抑制剂分子的积极结果,可以有效阻断更多突变形式的KRAS蛋白。
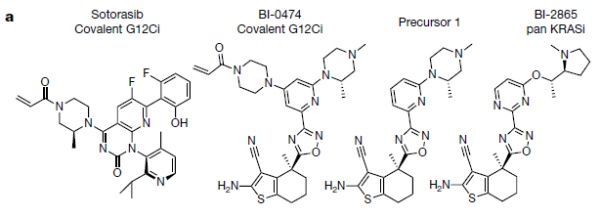
由KRAS突变驱动的癌症长期以来一直被认为是不可成药的,因为KRAS蛋白的表面光滑,缺乏适合小分子抑制剂结合的“口袋”结构,因此很难找到一种靶向药物分子来插入KRAS蛋白结构并抑制其活性。直到十年前,研究人员发现G12C突变的KRAS蛋白有一个小口袋结构,该结构通过与GTP发生可逆性结合来调节KRAS蛋白的活性(与GTP结合)/非活性(与GDP结合)状态。基于这一发现,研究人员开发出了可以进入“口袋”、并将KRAS G12C蛋白“锁定”在非活性状态的药物。但是这些药物对其他没有口袋结构的KRAS突变形式无效。为了解决这一问题,研究人员开始着手研发不限KRAS蛋白突变形式的小分子泛KRAS抑制剂。他们通过对一种已知的KRAS G12C共价强效抑制剂BI-0474进行结构修饰改造,并最终筛选优化得到了本研究的目的分子——BI-2865。BI-2865分子比前体分子更强效地抑制了携带KRAS G12C/G12D/G12V突变的BaF3细胞的增殖。在表达KRAS G12C的BaF3细胞中,BI-2865的效果与BI-0474和sotorasib相当。不过,当BaF3细胞在IL3存在的条件下接受BI-2865处理时,研究者们观察到的抗增殖效应很小。▲本研究中候选分子的化学结构式(图片来源:参考资料[1])
受到这些观察结果的鼓舞,研究人员进一步研究了BI-2865及其相关化合物在多种肿瘤类型中的抗癌效果。在体外细胞实验中,该化合物有效抑制了多种野生型和KRAS突变肿瘤细胞系中KRAS蛋白激活以及其下游信号传导的能力,这些细胞系源自肺癌、结肠癌或胰腺癌。当在人类胚肾293(HEK293)细胞中单独表达时,该抑制剂分子也能够使癌症中发现的24种最常见的KRAS突变蛋白中的18种失活。不仅如此,研究人员还发现,常见的KRAS突变蛋白在癌细胞中进行核苷酸循环——这是药物进入GDP结合型KRAS蛋白结构的必要条件,而不是固定在活跃状态,而且KRAS突变蛋白的循环动力学比野生型KRAS慢。这一发现更新了以往人们对KRAS突变蛋白的认知。“我们对BI-2865能够灭活最常见的致癌KRAS突变蛋白感到惊讶,”该研究的第一作者Dongsung Kim博士在谈及这些发现时说道,“这些突变蛋白被认为在癌症中处于活跃状态,但如果这是真的,那么这种药物将完全不起作用。这项研究为我们理解KRAS突变如何引起癌症开辟了一个新的方向。”事实上,研究结果表明,除了G12C突变之外,新的抑制剂还能够阻断其他类型KRAS突变蛋白的活性。创新作用机制,不针对特定突变的“泛KRAS”抑制剂
进一步的研究发现,BI-2865通过选择性地与仅在非活性状态下存在的KRAS蛋白表面上的口袋结构来靶向KRAS发挥作用,同时保留NRAS和HRAS的活性。这是基于RAS亚型的GTPase结构域的进化差异,虽然KRAS、NRAS和HRAS的GTPase结构域高度同源,但这些蛋白之间也有少数非同源氨基酸的存在,这些非同源氨基酸赋予了KRAS正构/变构区域的特殊性。在实验中,BI-2865以高亲和性优先与KRAS的非活性状态结合,但不与NRAS或HRAS结合。由于HRAS、NRAS可有效被激活和代偿KRAS的功能,该抑制剂分子对野生型细胞增殖能力的影响也很小,有助于减少潜在的治疗副作用。这种结合也能够稳定KRAS的非活性构象,防止它与下游效应物相互作用,从而阻断致癌信号。此外,BI-2865不与KRAS形成共价键,这与以前通过抑制KRAS功能来发挥疗效的KRAS抑制剂有着明显区别。这种作用机制的好处在于它不需要与特定的突变氨基酸共价结合,有望同时对多种KRAS突变蛋白发生作用。将“泛KRAS”抑制剂分子推向临床,还有多远的路要走?
在本研究中,BI-2865有效阻断了多种癌细胞系(包括肺癌、结肠癌和胰腺癌)的生长,它在KRAS基因突变引起的肺癌和结直肠癌小鼠模型中也有效。BI-2865的结构类似物(结构经优化后适用于体内给药)在携带KRAS G12C、G12D、G12V和A146V突变的小鼠中显著减弱了肿瘤生长,并且没有对小鼠造成明显的毒性。BI-2865的抗肿瘤作用与其良好的药代动力学特性相关,血浆和肿瘤中的药物暴露量、肿瘤模型中ERK磷酸化和DUSP6 mRNA表达的一致抑制证明了这一点。鉴于BI-2865在临床前研究中的良好表现,研究人员正在筹划将其推进至临床研究阶段。BI-2865是由勃林格殷格翰(Boehringer Ingelheim)的研究人员开发的,但该分子只是一种原型药分子(prototype),在患者身上进行临床试验之前需要对其加以改进,勃林格殷格翰目前正在针对BI-2865的临床开发进行优化。纪念斯隆-凯特琳癌症中心的研究人员表示,他们也将与勃林格殷格翰的研究团队保持密切合作,以期在未来一年内制造出可以用于临床试验的药物。KRAS是癌症中最常见的突变蛋白之一,其成药性难题一直以来是生物医药行业的一大“圣杯”。本研究无疑是KRAS癌症疗法开发的又一突破,其所发现的泛KRAS抑制剂更是值得在KRAS基因突变驱动的癌症患者中进行深入的临床开发。倘若成功,它将为广大癌症患者带来福音。同时,该研究所揭示的创新药理机制为开发针对KRAS以及其他致癌蛋白的新癌症疗法奠定了坚实的基础。




{replyUser1} 回复 {replyUser2}:{content}