一波三折,这种百年怪病的首款疗法是如何诞生的?
在千帆过尽的医药领域,每一步突破都蕴藏着无数次尝试和失败,每一种新药的诞生都凝聚了无数人日以继夜的辛勤努力,只为那一个个翘首以盼的患者寻找一线生机。有这样一款药物,它曾被预言有望成为领域内的“重磅炸弹”,也曾数次推迟上市、前途未卜。在今天的这篇文章里,药明康德内容团队将结合公开资料,与各位读者一道回顾一款针对“百年怪病”开发的新药Skyclarys(omaveloxolone)一波三折的上市历程。

一种“禁锢灵魂”的怪病
在19世纪50年代,德国医生尼古拉斯·弗里德赖希(Nikolaus Friedreich)注意到了一种特殊的共济失调,这种疾病的症状最初只出现在腿部,然后进展到手臂,此外还伴有眼球震颤、构音障碍(由于语言肌肉无力而导致言语困难)、脊柱侧弯和弓形足,一些患者还会出现关节感觉丧失和视觉障碍。也就是说,这种疾病会随着时间的流逝逐渐剥夺患者与外界产生交流的各种方式,慢慢“禁锢灵魂”。
许多医生试图将这种共济失调归类到现有的诊断中去,例如由梅毒螺旋体感染导致脊髓受损,从而引发的共济失调,或是多发性硬化。但这种共济失调显然和这两类疾病有很大区别,它具有遗传性,且发病年龄早、持续时间长。1863年,对这种共济失调深有研究的弗里德赖希医生首次在论文中对其进行了描述,包括来自2个家庭的6名患者。

图片来源:123RF
十多年后,他又发表了几篇论文,使这一疾病被报道的患者数增加到了3个家庭的9名患者。在文章中,弗里德赖希医生从病理解剖学角度发现,患者的脊柱背侧存在退行性变化,心肌存在着明显的脂肪变性,推测这可能是患者的病情加速恶化的原因。这些发现使他更加确信自己发现了一种新疾病。随着更多医生发现了与他描述的症状相符的患者,这种疾病最终被命名为“弗里德赖希共济失调症(FA)”。
1887年,已经有100例FA病例被报告。在此之后,神经遗传学家Anita Harding进一步定义了这种疾病,将隐性遗传加入到诊断标准,使得FA被清晰地区别于其他形式的小脑性共济失调。据估计,目前全球大约有2万多名患者受此病影响。
到1980年,经过一系列研究,科学家们证实了FA是一种线粒体疾病,其致病原因是FXN基因中的GAA重复扩增,导致一种存在于线粒体内的共济蛋白(frataxin)的水平显著降低。共济蛋白的缺失引发了抗氧化防御失调,可能进一步导致线粒体功能障碍、Nrf2信号传导受损和ATP(体内能量的主要来源)产生减少,这可能是FA患者出现疲劳、肌无力、运动不耐受和协调性下降等症状的原因。
疗法开发数十年未有结果,首款疗法终于萌芽
由于FA是一种单基因疾病,早期的研究人员们认为开发这种疾病的疗法应该很简单。研究人员首先对共济蛋白展开了研究。他们发现共济蛋白可能是一种铁结合蛋白,FA患者中共济蛋白的大幅度减少导致的铁沉积可能是FA的致病机制。于是,研究人员尝试着使用铁鳌合剂治疗FA。
随着研究的进一步开展,科学家们发现FA患者中的铁浓度增加只是次要事件,此外,铁鳌合剂只能降低血浆铁浓度(FA患者的这一指标是正常的),而不能降低关键的线粒体中的铁浓度。因此,这种方法失败了。
随后,科学家们又进行了诸多尝试。一些证据表明FA的发病是由于氧化防御早期受损,研究人员于是尝试使用多种抗氧化剂例如维生素E、辅酶Q10等对FA患者进行治疗,但均没能获得令人满意的结果。

图片来源:123RF
此前的这些尝试虽然都失败了,但也为针对FA的药物开发排除了许多“错误答案”。于是,屡败屡战的研究人员打算从一个新的角度——恢复线粒体功能来开发针对性的新药。我们知道,共济蛋白缺乏会导致Nrf2信号传导受损。而此前的研究表明,Nrf2是一种诱导多个分子通路的转录因子,这些分子通路能够通过恢复线粒体功能、降低氧化应激、抑制促炎信号而减轻炎症反应。那针对Nrf2信号通路的疗法是否有望治疗FA?
随着研究的进一步深入,科学家们证实了针对Nrf2的激动剂有望成为该疾病的有效疗法。2017年的一项临床前研究表明,两种Nrf2诱导剂——从十字花科蔬菜中发现的萝卜硫素(SFN)和用于治疗帕金森病的富马酸二甲酯(DMF)均能够穿过血脑屏障,并显著上调共济蛋白缺乏型运动神经元中的Nrf2及其靶基因。这种激活有助于通过还原型谷胱甘肽(GSH)的补充和减轻活性氧(ROS)相关的损伤来稳定FA中的氧化还原环境,从而最终抵消神经变性。
基于这些发现,Reata Pharmaceuticals公司的研究人员开发出了Nrf2激动剂omaveloxolone,并很快得到了这种候选疗法的初步验证结果——在体外研究中,omaveloxolone可恢复FA患者成纤维细胞和多个FA小鼠神经元模型的线粒体功能。

这一次,针对FA的新候选疗法的研究似乎开展得很顺利,一开始也确实如此……
上市进程多次受阻,多方坚持终迎喜讯
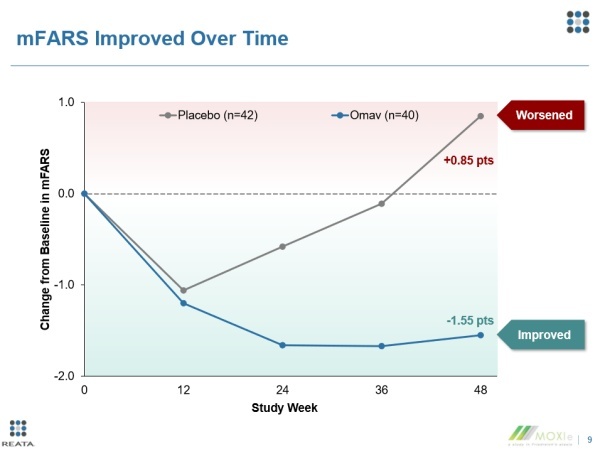
2017年,Reata公司公布了关于omaveloxolone的一项2期试验MOXIe的第一部分的积极数据,并确定了omaveloxolone的最佳剂量。两年后,Reata公司公布了这项临床试验第二部分的关键数据。这部分研究共有103名FA患者参与其中,研究人员使用一种由医生进行评估的神经学评定量表——共济失调神经系统评定量表(mFARS)来评估FA的疾病进展情况。该量表包括四个部分——说话和吞咽、上肢协调、下肢协调以及站立和行走,以测量患者的活动表现。
研究结果显示,治疗48周后,接受omaveloxolone治疗患者的mFARS得分不论是与安慰剂组患者相比,还是与患者自身在研究开始前的水平相比均获得了显著的改善,达到了试验的主要终点。此外,与研究第一部分的结果相呼应,在具有弓形足的患者中,omaveloxolone在mFARS上产生的改善更大。基于这些结果,Reata公司向FDA递交了omaveloxolone的新药申请。
对于这个结果,Baird公司的一位生物技术高级研究分析师在一份研报中对omaveloxolone表示十分看好,并将Reata公司此次数据公布称为“重大惊喜”,甚至认为这款药物有望成为“重磅炸弹”。
与此同时,另一家公司Stifel的金融分析师对这款药物的潜力持负面态度,因为Reata公司公布的数据缺乏药物相关严重不良反应和关键次要终点的结果。而且,在FA药物开发领域,几十年来还没有人能成功过——此前已有超过15项临床试验没能达到其主要终点。
而在omaveloxolone公布2期试验的关键数据前几天,它也遇到了上市进程中的第一个挫折——艾伯维(AbbVie)放弃了对Reata包括omaveloxolone在内的Nrf2激动剂的投资。随后,又一个坏消息接踵而至。2020年11月,Reata公司表示该药的上市计划可能会推迟3个月,因为美国FDA认为他们提供的关键试验的补充数据还不足以支持该药获批,需要开展针对FA的新试验。
为了提供更多支持性的数据以推进omaveloxolone上市,Reata公司开展了MOXIe的扩展研究。这项试验的结果发表由费城儿童医院的首席研究员David Lynch教授主导。幸运的是,扩展研究的结果很积极——接受omaveloxolone治疗的患者在三年后,与自然史研究中匹配的未治疗患者相比,其mFARS评分更低。2022年5月,Reata公司重新提交了该疗法的新药申请。
然而,尽管补充了MOXIe扩展研究的积极数据,FDA依然认为omaveloxolone的功效有待商榷,并继续推迟了最终裁定的时间。数万FA患者是否能迎来首款疗法,一切都是未知数。
监管机构的灵活变通促成“多赢”佳话
在新药的获批中,FDA对药物安全性和疗效严格的审查制度保证了其批准的药物能为患者提供超过已知潜在风险的获益。通常而言,一款新药的获批需要提供两项临床试验的积极结果来证明其疗效和安全性结果是可重复的,但偶尔也会有一些例外的情况。如果针对的疾病非常罕见以致无法开展多项临床试验,且这些患者存在着巨大的未满足需求时,可以利用FDA的“最广泛的监管灵活性(broadest regulatory flexibility)”原则可以暂时取消某些要求,以加快药物的授权或许可程序。但需要注意的是,这并不意味着降低对待审查药物安全性和疗效的要求。提出申请的公司还是必须提交足够多的证据以展示申报上市的药物给患者带来的获益要远大于其潜在风险。
目前,有许多新药已成功利用该原则获批上市,例如一款针对肌萎缩侧索硬化(ALS)的新药Relyvrio在2022年获批,用于治疗阿尔茨海默病的疗法Leqembi也在2023年1月获得了加速批准。在上市后,该疗法如果能获得临床获益验证,才能转化为完全批准。近期,Leqembi获得了FDA委员会的全票支持,有望成为20年来获得FDA完全批准的首款阿尔茨海默病新疗法。
这一次,面对omaveloxolone,FDA在再三的考量下最终做出了同样的选择。2023年3月1日,FDA批准了omaveloxolone的新药申请,首款可用于治疗FA的药物诞生了!
后记
在得知这一消息后,最开心的莫过于FA患者和为这款新药的上市付出了大量努力的参与者们。肌肉萎缩症协会(MDA)的全国副总裁,同时也是两例FA患者的父亲Tom Henry先生表示:“Omaveloxolone的获批带给了像我们这样的家庭希望,我们所爱的患有遗传性神经肌肉疾病的家人可以活得更久而不用遭受痛苦。许多人认为开发罕见遗传病的治疗方法是不可能的,但我们的家人和MDA自始至终没有动摇过,这些持续的努力才使今天成为了可能。”
医、患、研多方的坚持,与在保证患者安全的基础上为患者尽可能争取最大获益的监管机构的努力,最终换来了首款FA疗法的诞生。让我们向这些人类健康的守护者表示最深切的敬意!
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}