根据PDUFA的预期目标日期,预计7月,美国FDA将对4款创新药物的批准做出监管决定。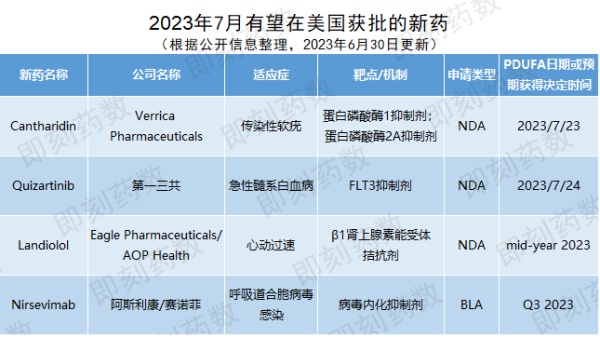
▲7月有望在美国获批的新药(药明康德内容团队制图,点击可见大图)公司名称:Verrica Pharmaceuticals
Verrica Pharmaceuticals公司开发的cantharidin (VP-102)是一种药械组合,包含蛋白磷酸酶2A抑制剂斑蝥素(0.7%溶液),通过一次性涂抹器局部给药。软疣是一种具有高度传染性的常见病毒性皮肤病,主要感染对象为儿童等免疫力低下的人群。该疾病是由痘病毒引起的,可导致独特的隆起、泛红的皮肤损伤,从而引发疼痛、炎症、瘙痒和细菌感染。在美国估计影响了600万人,主要是儿童。目前针对软疣还没有FDA批准的治疗方法,是皮肤病中最大的未竟需求之一。FDA于2023年3月重新受理了该药物的新药申请(NDA),PDUFA日期设定为今年7月23日。这一NDA申请是基于两项3期临床试验(CAMP-1和CAMP-2)结果。试验结果显示,cantharidin在减少病变和完全清除感染方面显示出统计学意义上的显著疗效,达到主要终点。除软疣适应症外,Verrica公司还在开发该候选药物用于普通疣和外生殖器疣,这是皮肤科中最常见的三种病毒性皮肤病。公司名称:第一三共(Daiichi Sankyo)
第一三共公司开发的quizartinib是一款口服、具选择性的2型FLT3抑制剂。FLT3基因突变发生在大约30%的AML患者中,可以驱动致癌信号。内部串联重复(ITD)是FLT3基因最常见的突变类型,其中约有25%新确诊的AML病患带有FLT3-ITD突变,此突变与复发风险的增加和较短的总生存期相关。据估计,2022年在美国约有2万人确诊患有AML,AML患者的5年生存率约为30.5%,FLT3-ITD阳性AML患者的5年生存率约为20%。
FDA于2022年10月受理了该药物的NDA申请并授予其优先审评资格,PDUFA日期设定为今年4月后延长时间至今年7月24日。这一NDA申请是基于名为QuANTUM-First的3期临床试验结果。数据分析显示,与标准治疗对照相比,接受quizartinib联合标准诱导和巩固化疗治疗,然后继续接受quizartinib单药治疗的新确诊的FLT3-ITD阳性患者在经过39.2个月中位追踪时间后,quizartinib组的中位总生存期达到31.9个月(95% CI:21.0-NE),是对照组中位总生存期15.1个月(95% CI:13.2-26.2)的两倍以上。
药物名称:Landiolol (AOP-200704)公司名称:Eagle Pharmaceuticals/AOP Health
Eagle Pharmaceuticals和AOP Health公司开发的landiolol是一种超短效、心脏选择性的β1肾上腺素能受体阻滞剂,通过阻断神经递质去甲肾上腺素和肾上腺素与受体结合而降低心率。这些神经递质促进了心动过速的发生。Landiolol被设计用于急诊、重症监护和手术室环境。该药物已在日本和几个欧洲市场以上市。2022年6月,Eagle Pharmaceuticals和AOP Health公司旗下的AOP Orphan Pharmaceuticals公司宣布已向FDA递交landiolol的NDA申请,用于室上性心动过速(SVT)患者短期降低心室率,包括房颤和房扑。新闻稿指出根据与FDA进行的Type C会议提供的反馈预计将于2023年年中获得该药的审批决定。这一NDA的递交基于已有安全性和疗效数据的总结和已发表随机对照试验的荟萃分析。FDA认为数据集足以支持拟定的NDA。公司名称:阿斯利康(AstraZeneca)/赛诺菲(Sanofi)
阿斯利康和赛诺菲联合开发的nirsevimab是一种设计为所有婴幼儿设计的长效抗体疗法,从婴幼儿出生到第一个呼吸道合胞病毒(RSV)季节只需一剂就能预防与RSV感染相关的疾病。该药物无需激活免疫系统便能提供及时、快速和直接的疾病免疫保护。RSV是造成包含细支气管炎与肺炎等下呼吸道感染的最常见原因。它也是全世界导致婴幼儿住院的首要原因。在2019年,全球约有3300万急性下呼吸道感染病例,造成超过300万人住院,以及26300位5岁以下婴幼儿住院时死亡。FDA于今年1月受理了nirsevimab的生物制品许可申请(BLA),并预计在2023年第3季度公布审查结果。这一BLA申请是基于MELODY临床3期、MEDLEY临床2/3期与一项临床2b试验的结果。根据去年3月所公布的数据,MELODY临床3期试验达主要终点,与安慰剂相比,nirsevimab单次给药将RSV引起的需要接受治疗的婴幼儿下呼吸道感染(LRTI)发生率降低了74.5%(95% CI:49.6-87.1,p<0.001)。值得一提的是,去年11月该抗体药物曾获得欧盟全球首次批准上市,今年6月初,FDA抗菌药物咨询委员会(AMDAC)投票建议批准nirsevimab用于预防婴儿RSV疾病。







{replyUser1} 回复 {replyUser2}:{content}