随着医学的进展与突破,自21世纪以来癌症治疗的方式产生巨大变化,实质上显著改善患者的预后。近期,《自然》子刊Nature Reviews Drug Discovery发布一篇综述文章,详细检视了21世纪初期起至近日,美国FDA对抗癌疗法批准的趋势。药明康德内容团队向读者介绍其中关键内容,期待借此获得关于未来癌症疗法开发的洞见。

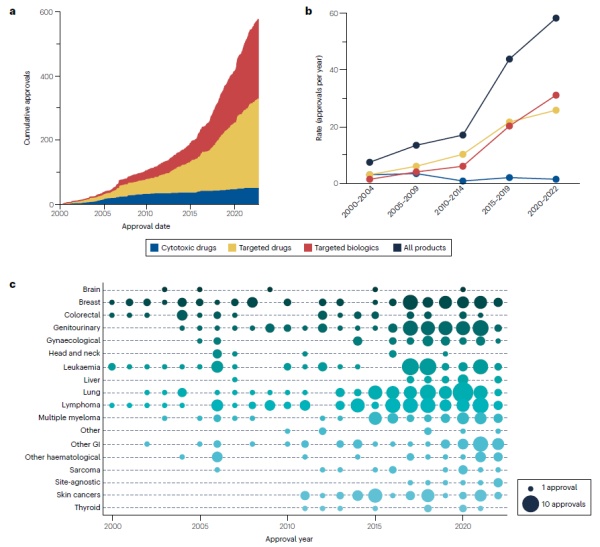
有数十年的时间,癌症疗法仅限于影响快速分裂细胞的全身性细胞毒性药物,这些药物同时靶向癌细胞和健康组织,因此通常具有显著的毒性。然而自20世纪90年代末和21世纪初,随着靶向治疗的出现,癌症治疗的格局发生了巨大变化。自2000年起至2022年10月(分析期间),在靶向疗法获批的推动下,FDA在批准癌症适应症上的速度有所提高,创新疗法的引入速度亦增快。总体而言,在此段期间内,有206个不同的肿瘤疗法获得共573项肿瘤适应症批准,其中细胞毒性药物、靶向药物与生物制品分别占了50项、277项与246项。而在期间内FDA的批准速度亦急剧增加;以5年为期的平均年度批准数目从2000-2004年的每年7.4次,增加至2017年11月至2022年10月的每年56次(增加757%)。获批疗法的数量和时间也随着不同类型癌症而异。在整个分析期间,皆有乳腺癌、白血病和淋巴瘤疗法获得批准,而脑癌和头颈癌在分析期间的批准数则较少。而皮肤癌和甲状腺癌,在2000年至2010年没有新疗法获批,然而这两类癌症近年来每年批准的数量有明显增加。自2015年以来,肺癌、淋巴瘤、泌尿生殖系统癌症、乳腺癌和白血病获得最多的批准,在过去8年内,每种癌症均获得超过35项批准。▲FDA批准癌症疗法总观(图片来源:参考资料[1])
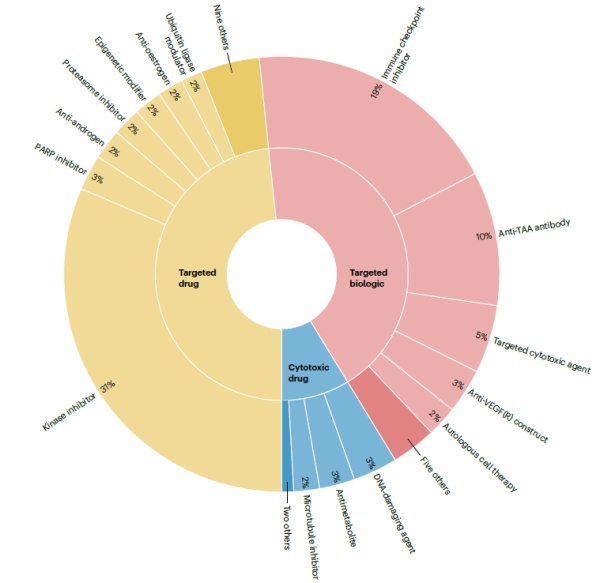
疗法类型分析显示,与所有其他类别疗法相比,靶向药物中的激酶抑制剂具有最高数量的不同药物,其获批的数量也最多。激酶抑制剂在整个分析期间皆有新批准药物。批准数量第二多的类别是靶向生物制品免疫检查点抑制剂(ICI),尽管此类药物直至2011年才首次上市。激酶抑制剂和ICI在2022年的批准数量相同(9项),在此之前5年的批准数量亦相似(分别为91和82项)。此数据显示ICI自其“first-in-class”药物获批以来的11年中对癌症治疗产生相当大的影响,同时也显示激酶抑制剂在整体癌症疗法领域的持续重要性。自2000年以来,有5种不同疗法分别获得了12项以上的批准,包含3种ICI(pembrolizumab、nivolumab、atezolizumab)、1种抗血管内皮生长因子(VEGF)抗体(bevacizumab)和1种激酶抑制剂(imatinib)。这些产品都是靶向药物或生物制品,分析期内没有细胞毒性药物有超过6项批准。细胞毒性药物的早期主导地位和靶向药物和生物制品的在后期崛起的趋势明显。许多细胞毒性药品种类,如DNA损伤剂、抗代谢物和微管抑制剂,大多在2010年之前获得批准。在2010年以后细胞毒性药物多与靶向药物或生物制品作为组合疗法,共有53项适应症获批。▲不同癌症疗法类型与疾病区域获批趋势(图片来源:参考资料[1])
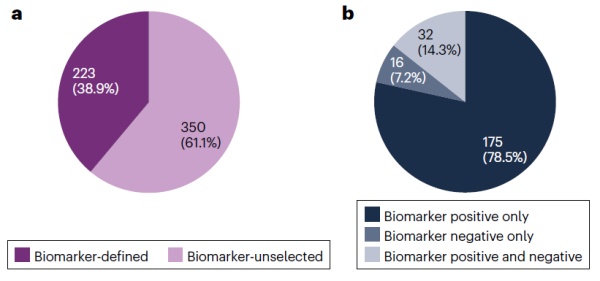
在分析期间,206项获批的肿瘤靶向疗法中共包含83个分子靶标。大部分靶标是由单个基因编码的蛋白(n=73);其他靶标包括两个融合蛋白、两个蛋白复合物、两个蛋白家族、一个氨基酸、一个糖脂、一个肽和DNA。其中EGFR、DNA、CD19和HER2是被最多不同种类疗法所靶向的靶点。而PD-1、EGFR和BCR-ABL1融合蛋白则是拥有最多获批适应症的靶点,其中PD-1获批数量(n=76)是EGFR(n=30)的2倍多。靶向PD-1与BCR–ABL1融合蛋白的疗法种类分别仅限于ICI与激酶抑制剂,而靶向EGFR的疗法则包含多种产品类别(激酶抑制剂和双特异性抗体等)。由此可见,ICI和激酶抑制剂是通过靶向少数靶标而获得大量批准。此外,分析发现,大多数获批癌症疗法(61.1%)可用于生物标志物非选择性病患,但仍有38.9%(223/573)的批准疗法仅限用于生物标志物定义的患者。获批疗法中最常见的指定生物标志物包含HER2、EGFR、BRAF、HR(激素受体:雌激素受体[ER]和/或孕激素受体[PR])和费城染色体。在生物标志物定义的群体中,大多数批准仅针对生物标志物阳性的肿瘤(78.5%)。有32项批准(14.3%)要求患者肿瘤对某些生物标志物呈阳性,对其他生物标志物呈阴性,另有16项批准(7.2%)仅针对生物标志物阴性的肿瘤。在分析期间,获批的癌症适应症中生物标志物的使用略有增加。2000-2004年间有32%的批准使用生物标志物,2005-2009年间为30%,然后在2020-2022年稳步上升到43%。▲生物标志物于获批癌症疗法的应用(图片来源:参考资料[1])
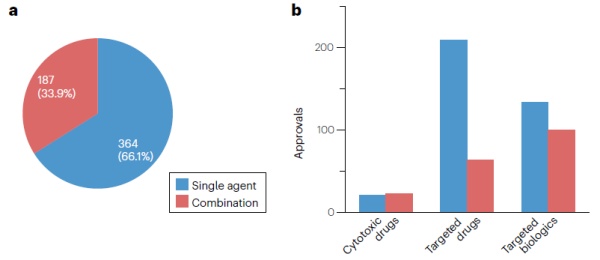
分析显示,自2000年以来,单药疗法约占肿瘤获批适应症的三分之二(364/551),另有约三分之一(187/551)为组合疗法。其中细胞毒性药物作为组合疗法的应用最多(占批准数52%),其次为靶向生物制品(43%),而靶向药物作为组合疗法获批的适应症则较少,仅占此类药物总批准数的23%。疗法种类上,激酶抑制剂、ICI和抗肿瘤相关抗原(TAA)抗体的作为组合疗法的获批适应症数量最多(分别为41、40和38),分别占各自获批适应症总数的23%、38%与68%。▲获批单药/组合癌症疗法分析(图片来源:参考资料[1])
监管趋势方面,在分析期间,有71%(407/573)的癌症疗法批准使用常规批准(RA)途径,有29%(166/573)使用加速批准(AA)途径。尽管近年来通过AA批准的适应症总数有所增加,但这趋势其实反映了分析期间批准量的总体增加。AA的使用在分析期间相对稳定,2000-2022年AA占总批准数的平均年百分比为30.6%(中位数29.4%;范围10-71.4%)。在过去5年中,AA的平均年百分比为28.4%(中位数27.3%;范围24.6-34.4%)。除了上述的细胞毒性药物、靶向药物与生物制品外,随着科学不断进步,各种创新疗法也不断增加。例如,近6年来自体细胞疗法便作为一种新型、变革性的治疗方法出现。该类疗法共有13个获批项目,其中仅2022年就有4个。其中12个是嵌合抗原受体(CAR)-T细胞疗法,均自2017年后获批。此外于分析期间,8项不限癌种的批准使用了生物标志物,其中包含BRAF V600E突变、NTRK融合、RET融合、高肿瘤突变负荷(TMB,>10个突变/兆碱基)、高微卫星不稳定性(MSI-H)或DNA错配修复缺陷(dMMR),和仅有dMMR。自2017年首个不限癌肿疗法获批以来,这类以独特生物标志物来定义疾病的疗法,维持稳定每年1次的批准,直至2022年有3项批准,这3项所批准的疗法均根据特定基因改变(BRAF V600E突变和RET融合)的生物标志物。总体而言,肿瘤疗法开发的步伐和创新皆有增加的趋势。让我们期待在未来有更多造福患者的疗法获批,使得肿瘤治疗和癌症患者的预后能有进一步的改善。




{replyUser1} 回复 {replyUser2}:{content}