1. Alnylam Pharmaceuticals公司的RNAi疗法zilebesiran有望实现半年一针控制高血压。
2. Acumen Pharmaceuticals公司用于治疗阿尔茨海默病的单克隆抗体新药ACU193可使患者的淀粉样斑块呈快速、剂量相关的显著减少。3. Alnylam和再生元(Regeneron)公司合作开发的在研RNAi疗法ALN-APP,单剂治疗即可快速持久地降低阿尔茨海默病患者脑脊液中与淀粉样前体蛋白(APP)相关的2种生物标志物,最高降幅均超过80%。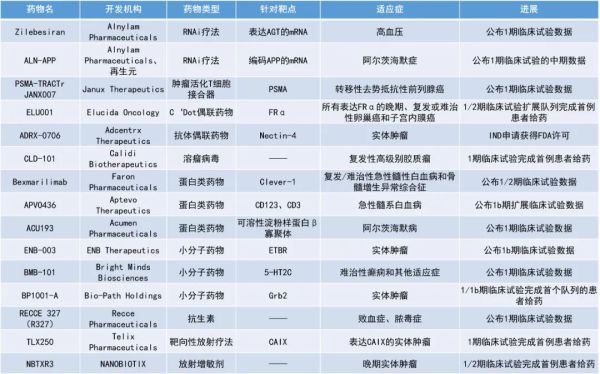
Alnylam Pharmaceuticals公司公布了其RNAi疗法zilebesiran的1期研究结果。Zilebesiran是一款靶向表达血管紧张素原(AGT)的mRNA的RNAi疗法。血管紧张素原是血管紧张素的前体。通过降低肝脏中血管紧张素原的生成,该药可以降低血管紧张素的水平,从而达到一致且持久的血压降低。此次公布的关键数据显示,与安慰剂相比,zilebesiran对血清AGT的降低具有剂量依赖性,实现了24小时内持续、持久的血压控制,在单次使用≥200 mg的zilebesiran后,疗效可持续6个月。Zilebesiran还表现出可接受的安全性,最常见的治疗相关不良反应是轻微、短暂的注射部位反应。Acumen Pharmaceuticals公司公布了其新药ACU193用于治疗阿尔茨海默病的1期临床试验的积极顶线结果。ACU193是一种选择性靶向毒性可溶性β淀粉样蛋白寡聚体(AβOs)的选择性人源化单克隆抗体。ACU193能够结合AβOs,由于其独特的结合特性,ACU193有可能在产生淀粉样蛋白相关成像异常(ARIA,一种抗体疗法产生的常见主要副作用)风险较低的情况下提供治疗益处,因为ACU193可以在不直接靶向淀粉样斑块的情况下阻断AβOs的毒性作用。该试验的初步结果达到了主要和次要目标,为ACU193的临床机制验证提供了证据。在较高剂量组的患者中观察到淀粉样斑块快速、剂量相关的显著减少(p=0.01),每四周给药一次60 mg/kg ACU193组患者的淀粉样斑块在第63天减少了25%,每两周给药一次25 mg/kg ACU193组患者的淀粉样斑块在第70天减少了20%。这一结果与已批准的Aß单克隆抗体在其临床开发阶段相似时间点的平均淀粉样蛋白斑块减少相当。安全性方面,ACU193在早期阿尔茨海默病患者中耐受性良好,未发生与药物相关的严重不良事件,所有队列的ARIA-E(意味着大脑某个或多个区域因为ARIA出现暂时性肿胀)发生率较低,总体发生率为10.4%。此外,观察到与ACU193剂量相关且超预期的中心靶点作用,血清和脑脊液的药代动力学结果支持每月一次的给药频率。Alnylam和再生元公司公布了其在研RNAi疗法ALN-APP在首个人体临床试验中获得的积极中期结果。ALN-APP是一种针对APP的RNAi疗法,用于治疗阿尔茨海默病和脑淀粉样血管病。试验结果显示,ALN-APP不但表现出良好的安全性和耐受性,而且单剂治疗快速持久地降低了脑脊液中与APP相关的生物标志物,可溶性APPα(sAPPα)和可溶性APPβ(sAPPβ)的最高降幅分别为84%和90%。接受单次给药后6个月时,患者sAPPα的平均降幅超过55%,sAPPβ的平均降幅超过65%。该公司表示,将启动1期研究的多剂量递增试验,以更多地了解这种新方法对这些破坏性疾病的潜力。ADRX-0706是Adcentrx Therapeutics公司开发的一种候选抗体偶联药物(ADC)。其抗体成分靶向Nectin-4,这是一种在多种人类癌症中过度表达并与疾病预后不良相关的细胞表面粘附蛋白。该ADC采用Adcentrx专有的共轭技术和新型微管蛋白抑制剂有效载荷制成,药物抗体比为8。ADRX-0706在临床前模型中表现出良好的药代动力学和安全性,并在多种肿瘤适应症中表现出显著的疗效。PSMA-TRACTr JANX007:公布1期临床试验数据Janux Therapeutics公司公布了其肿瘤活化T细胞接合器PSMA-TRACTr JANX007治疗转移性去势抵抗性前列腺癌(mCRPC)成人患者的1期临床试验的中期数据。结果显示,多例接受该疗法治疗患者的前列腺特异性抗原(PSA)显著下降,安全性和细胞因子释放综合征均在可控范围内,且无剂量限制性毒性反应。Aptevo Therapeutics公司公布了其双特异性重组蛋白疗法APVO436与维奈托克(venetoclax)和阿扎胞苷联用,在针对急性髓系白血病(AML)患者的1b期剂量递增试验中取得的积极结果。APVO436是一种创新双特异性重组蛋白,它像两个单克隆抗体连接在一起,可以同时靶向肿瘤细胞表面的CD123和T淋巴细胞表面的CD3,从而将宿主免疫系统的T细胞重定向到患者的肿瘤细胞上,以快速和完全摧毁表面表达CD123的肿瘤细胞。APVO436经改造后可在血液循环中停留足够长的时间,以发现、结合并破坏白血病细胞。此次公布的结果显示,患者对该三联疗法的缓解率达82%(9/11),27%(3/11)的患者缓解充分,可继续接受干细胞移植。此外,在有缓解的患者中,有一名患者持续完全缓解达8个周期(方案允许的最长周期),这意味着缓解持续时间(DOR)至少为8个月。目前,中位DOR尚未达到。Bexmarilimab:公布1/2期临床试验数据Faron Pharmaceuticals公司公布了其免疫疗法bexmarilimab正在进行的1/2期研究的积极临床进展。Bexmarilimab是Faron公司全资拥有的研究性免疫疗法,旨在通过靶向髓系细胞功能和激活免疫系统,克服对现有疗法的耐药性并优化临床疗效。Bexmarilimab能与巨噬细胞上的免疫抑制受体Clever-1结合,该受体有助于肿瘤生长和转移(即帮助癌症躲避免疫系统)。通过靶向巨噬细胞上的Clever-1受体,bexmarilimab可改变肿瘤微环境,将巨噬细胞从免疫抑制(M2)状态重编程为免疫刺激(M1)状态,上调干扰素的产生,启动免疫系统攻击肿瘤,使癌细胞对标准治疗敏感。此次公布的结果显示,在服用bexmarilimab和阿扎胞苷的三个剂量组(1 mg/kg、3 mg/kg和6 mg/kg)中,共有8名受试者达成客观缓解。在接受bexmarilimab、阿扎胞苷和白血病治疗药物Venclexta三联疗法的6名受试者中,有4人出现了客观缓解。ENB Therapeutics公司公布了其在研选择性内皮素B受体(ETBR)抑制剂ENB-003与PD-1抑制剂pembrolizumab联用治疗难治性晚期实体瘤患者的安全性和有效性数据。在临床前研究中,ENB-003提高了CAR-T细胞疗法和PD-1抑制剂在多种癌症类型的实体瘤中的疗效。在一项正在进行的多中心1/2期临床试验中,早期疗效信号表明,ENB-003能克服接受过多线治疗后耐药的癌症患者对pembrolizumab的耐药性。此次公布的数据显示,ENB-003与pembrolizumab联用的耐受性良好,疾病控制率达(DCR)33%。该联合疗法的疗效似乎与ETBR的表达有关,接受2期推荐剂量(RP2D)的ETBR高表达患者的DCR为83%。此外,铂类药物难治性/耐药性微卫星稳定型卵巢癌患者的DCR为80%。BMB-101是Bright Minds Biosciences公司开发的下一代5-HT2C选择性和偏向性激动剂,被设计用于治疗难治性癫痫和其他适应症。在完善的预测性动物模型中,BMB-101能够使癫痫发作的次数和强度显著降低,有成为“best-in-class”药物的潜力。此次公布的1期临床数据显示,BMB-101在单剂量递增、多剂量递增和食物效应研究中均表现出极佳的安全性和耐受性。此外,BMB-101具有中枢靶向作用和可预测的血浆药代动力学特性。RECCE 327(R327):公布1期临床试验数据R327是Recce Pharmaceuticals公司开发的一种广谱合成聚合物抗感染药物,旨在解决严重或危及生命的细菌感染,包括脓毒症。研究表明,该化合物能够迅速且不可逆地关闭细菌细胞能量ATP的产生,使细菌的蛋白质合成减少和细胞膜去极化,在较高浓度下甚至可以导致细胞裂解。R327已被FDA授予快速通道资格。此次公布的结果显示,R327在8个队列共80名受试者中进行的1期临床试验达到了所有主要研究终点,符合国际监管标准,并证明了R327的安全和耐受性良好。






{replyUser1} 回复 {replyUser2}:{content}