斯坦福大学(Stanford University)的科学团队设计出一种全新的双功能分子,基于诱导接近(induced proximity)的作用机制,成功激活癌细胞的凋亡通路,为治疗淋巴瘤提供了全新的策略。
近日在一项发表于《自然》杂志的最新研究中,斯坦福大学(Stanford University)的科学团队设计出一种全新的双功能分子,基于诱导接近(induced proximity)的作用机制,成功激活癌细胞的凋亡通路,为治疗淋巴瘤提供了全新的策略。这也是异双功能分子在行使靶向蛋白降解、磷酸化等功能之外的又一突破,展现了诱导接近的作用机制革新小分子药物研发的广泛前景。
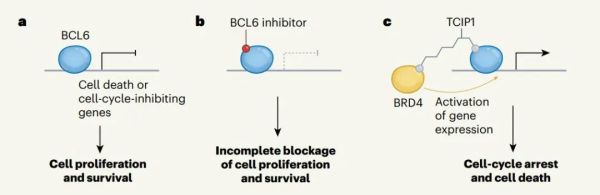
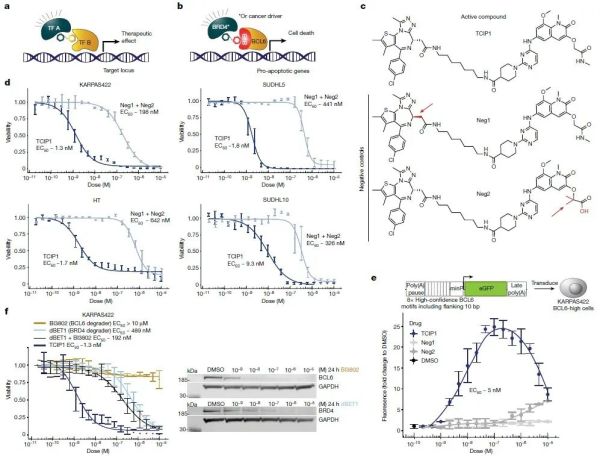
对于正常的细胞,死亡也是维持机体稳态的重要一环。细胞凋亡就是一种细胞主动死亡的过程:基因严格调控激活细胞凋亡的通路,通过死亡维持了机体内环境的稳态。但不是所有细胞都会本分地接受死亡的命运。癌细胞就是个特例,它们拥有的大量突变,帮助它们逃避细胞凋亡,成为在体内肆虐的“不死”细胞。了解到癌细胞不死的原因,如果我们能重新开启癌细胞凋亡通路的开关,是不是就可以找到对抗癌症的新武器呢?带着这样的想法,来自斯坦福大学的研究团队试图从生发中心(germinal center, GC)中寻找答案。生发中心是抗原特异性B细胞被抗原激活后在淋巴滤泡内形成的结构。在这里,生发中心B细胞经过分化、成熟,最终形成记忆B细胞或浆细胞进入淋巴循环。显然,生发中心对于形成抗体、对抗外来病原体很重要。但与此同时,生发中心也孕育着致命的危险。生发中心B细胞还是多种淋巴瘤的源头,常见的弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)就是其中之一。而B细胞淋巴瘤蛋白6(BCL6)就是促进癌细胞增殖的重要推手。作为一种转录抑制因子,BCL6会抑制参与细胞凋亡的基因表达。它们在DLBCL中常常会功能失调,大量结合细胞凋亡基因的启动子,抑制其表达,后果就是维持癌细胞大量增殖的状态。因此,一个很自然的想法是:通过抑制或降解BCL6,我们或许能找到抑制DLBCL等癌症发展的新策略。在一项发表于《自然》杂志的最新研究中,这些斯坦福大学的科学家就设计出了一种全新的化合物,通过连接BCL6与一种转录激活因子,重新激活了癌细胞的凋亡通路。这项突破有望为部分淋巴瘤的治疗提供全新的策略。在此前的研究中,科学家们已经发现了多种能抑制或降解BCL6的化合物,它们可以在体外实验中杀死DLBCL细胞。但这些化合物也存在一个不容忽视的缺陷:它们通过功能丧失(loss of function)的机制发挥作用,也就是说,需要实现对几乎所有BCL6分子的抑制或降解才能起效,否则对癌细胞增殖的抑制就是不完全的。既然“抑制”的策略极为苛刻,只需要改变一部分BCL6转录状态就能发挥作用的功能获得(gain of function)机制受到了斯坦福团队的青睐。尤其是在治疗体型较大、血管化不良因而药物难以富集的肿瘤时,功能获得策略有着明显的优势。研究团队实现这一目标的手段,是一种名为化学诱导接近(chemical inducers of proximity,CIP)的技术。简单来说,CIP就是使用化学小分子诱导两个蛋白靠近并发生蛋白质互作,进而调控细胞进程。▲研究团队用功能获得策略设计出的分子,通过实现BCL6与BRD4的互作,激活癌细胞凋亡通路(图c)(图片来源:参考资料[2])在这项研究中,他们就合成了一种这样的分子:分子的一端是BCL6的结合靶点,另一端则与转录激活因子BRD4结合,就如同一根线将两个蛋白绑定在一起。这种全新的分子化合物与BCL6、BRD4形成了复合物,BRD4的存在强有力地激活了原本被BCL6沉默的基因表达——包括那些参与细胞凋亡通路的基因。研究团队将这类新型分子命名为转录/表观遗传CIP(transcriptional/epigenetic CIP,TCIP),并且从中筛选出了功能最强的分子——TCIP1。在基因组的BCL6结合位点上,TCIP1将与BRD4的结合能力提升了50%,显著加速了促进细胞凋亡的基因表达,迅速进入转录延伸阶段。▲TCIP的合成过程,右上角为TCIP1的分子式(图片来源:参考资料[1])研究团队利用TCIP1治疗DLBCL细胞系,发现其上调了数百个基因的表达,其中很多已知是BCL6靶向的基因。在体外试管实验中,TCIP1有效杀灭了表达BCL6的DLBCL细胞,包括对化疗具有耐受性、TP53突变的细胞系,表明TCIP类化合物有潜力成为一类全新的抗癌分子。除了促进癌细胞的凋亡,研究团队观察到,TCIP1还下调了著名的致癌基因MYC的表达。目前,TCIP1下调MYC表达的机制仍需进一步的探索。论文指出,TCIP还可以被设计用于激活衰老细胞中的死亡通路,激活治疗性或单倍不足基因的表达,激活免疫治疗中新抗原的表达,或是通过对基因表达的调控实现合成生物学的应用。同期的评论文章则指出,除了实验中的DLBCL,这一策略还可能应用于其他表达BCL6的淋巴瘤(例如滤泡性淋巴瘤和伯基特淋巴瘤)的治疗。此外,该策略在再生医学、发育失调的治疗中也拥有潜在的应用前景。近年来,基于诱导接近这一作用机制开发的异双功能分子得到业界的广泛关注。它们的两端可以与不同靶点结合,将两种原本无交集的蛋白拉近到一起。此类分子的典型代表是称为PROTAC的靶向蛋白降解剂。蛋白降解之外,异双功能分子还可以起到磷酸化、去磷酸化、乙酰化、精准抑制靶点蛋白等功能。而TCIP分子代表着诱导接近机制的又一新篇章,给予小分子药物完成转录和表观遗传调控的能力。
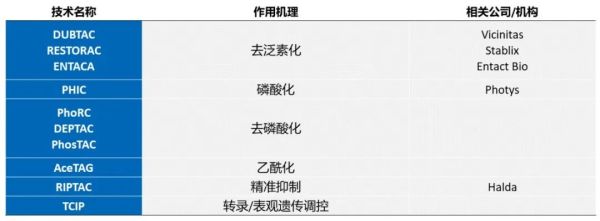
▲异双功能分子现已得到学术界和产业的广泛关注(数据来源:参考资料[3])
相关阅读:未来的小分子药物长什么样?
在2023药明康德全球论坛上,加州大学伯克利分校的Dan Nomura教授表示,目前多样化的技术平台让人们看到攻克此前不可成药靶点的希望,“关键是要给正确的靶点选择正确的疗法分子类型”。期待TCIP等新分子结构带来更多小分子药物的创新,早日为患者开发出更多新药好药。




{replyUser1} 回复 {replyUser2}:{content}