降低癫痫发作率89%的反义寡核苷酸疗法;全球首个针对苯丙酮尿症的基因编辑疗法进入临床... | 一周盘点
1. 治疗癫痫的反义寡核苷酸(ASO)在研新药STK-001的早期临床结果积极,末次给药后6个月时,癫痫的发作频率降低了89%。
2. 全球首个针对苯丙酮尿症(PKU)的基因编辑疗法HMI-103进入临床。
3. 同种异体树突状细胞疫苗VAC2治疗晚期非小细胞肺癌(NSCLC)的1期临床研究的初步结果积极。
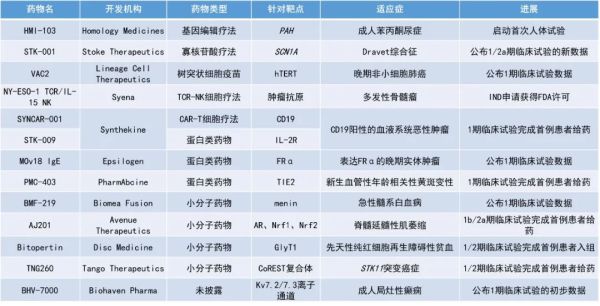

Stoke Therapeutics公布了其专有的ASO在研新药STK-001用于治疗Dravet综合征的早期临床试验的新数据。Dravet综合征是一种严重的进行性遗传性癫痫,其特征是在出生后第一年内,癫痫就开始频繁、长期发作,并且用药物难以控制。STK-001旨在通过利用SCN1A基因的野生型拷贝来上调NaV1.1蛋白表达,以恢复NaV1.1的水平,从而减少癫痫发作和非癫痫合并症的发生。新闻稿指出,STK-001有望成为首个解决Dravet综合征遗传原因的疾病修饰疗法。该疗法此前已被FDA和欧洲药品管理局(EMA)授予孤儿药资格,并被FDA授予罕见儿科疾病认定,作为Dravet综合征的潜在新疗法。
此次公布的结果显示,单剂量和多剂量的STK-001达到70 mg剂量时的耐受性良好。接受2剂或3剂70 mg剂量STK-001治疗的患者的抽搐发作频率持续大幅降低;与基线时相比,患者最后一次给药后3个月时的中位发作频率降低了80%(n=6),最后一次给药后6个月时的中位发作频率降低了89%(n=3)。接受30 mg、45 mg剂量的STK-001治疗患者的惊厥发作频率持续降低,认知和行为获得改善。
HMI-103:启动首次人体试验

HMI-103是一种一次性体内基因编辑候选药物,用于治疗PKU。PKU是一种由PAH基因突变引起的罕见先天性代谢错误疾病,若不及时治疗,苯丙氨酸在血液中的积聚将会导致进行性和严重的神经损伤。目前,尚无针对该疾病潜在遗传原因的治疗选择。HMI-103旨在利用人体同源重组的自然DNA修复过程,把具功能的PAH基因和肝脏特异性启动子整合到基因组,以最大限度地提高该基因的长期表达。新闻稿指出,该疗法是全球首个进入临床试验治疗PKU的候选基因编辑疗法。
VAC2:公布1期临床试验数据

Lineage Cell Therapeutics公布了其同种异体树突状细胞疫苗VAC2治疗晚期NSCLC的1期临床研究结果。VAC2有3个重要组成部分:树突状细胞(抗原呈递作用),人体端粒酶抗原(在95%的癌症中广泛表达,在正常细胞中鲜有表达),以及溶酶体靶向信号LAMP蛋白片段。VAC2能够让树突状细胞将人体端粒酶抗原呈现给T细胞,使它们靶向和杀伤表达人体端粒酶抗原的肿瘤细胞,而LAMP片段能够让VAC2同时激活细胞毒性T细胞和辅助T细胞对人体端粒酶抗原的反应,从而延长杀伤肿瘤细胞的免疫反应的持续时间。
此次公布的结果显示,接受治疗的8名患者中,有5名(62.5%)的最佳反应为免疫相关的疾病稳定,3名(37.5%)患者的最佳反应为免疫相关的疾病进展。8名接受治疗的患者中有3名(37.5%)达到了2年的生存期终点。酶联免疫斑点技术(ELISPOT)评估结果显示,2名患者对肿瘤抗原人类端粒酶逆转录酶(hTERT)的片段产生了持久的反应,另外2名患者产生了短暂的反应。总体而言,VAC2的耐受性良好,没有出现意外的严重不良反应,也没有出现剂量限制性毒性反应。
NY-ESO-1 TCR/IL-15 NK:IND申请获得FDA许可
NY-ESO-1 TCR/IL-15 NK是由Syena公司开发的工程化T细胞受体自然杀伤(TCR-NK)细胞疗法。该疗法使用源自脐带血的细胞,因此具潜力提供现货型、规模化的细胞疗法以治疗癌症。TCR-NK细胞疗法将工程化的TCR疗法与NK细胞结合,以改善其安全性与疗效。基于嵌合抗原受体(CAR)的疗法仅能辨认细胞表面的蛋白抗原,而TCR疗法则能辨认细胞内部的蛋白。将TCR与NK细胞结合使得细胞能够辨认由细胞表面免疫蛋白所呈现的外化蛋白片段。因此TCR-NK细胞疗法具潜力靶向范围更广的肿瘤抗原。近期,该疗法用于治疗多发性骨髓瘤的IND申请获得了FDA的许可,1期临床试验计划于2023年第三季度启动。
MOv18 IgE:公布1期临床试验数据
Epsilogen公司公布了其潜在“first-in-class”的IgE抗体MOv18 IgE治疗表达叶酸受体-α的晚期实体瘤患者的1期临床试验的积极数据。该试验采用皮肤点刺和嗜碱性粒细胞活化试验(BAT)来选择过敏毒性风险最低的患者。试验结果显示,该疗法的安全性是可以耐受的,目前尚未达到最大耐受剂量。最常见的不良反应是一过性的荨麻疹,1名患者出现了过敏性休克,可能是因为基线时检测到了可被MOv18 IgE激活的循环嗜碱性粒细胞。此外,在1名卵巢癌患者身上观察到了MOv18 IgE具有抗肿瘤活性的初步证据。这些结果证明了MOv18 IgE具有治疗癌症的潜力。
BMF-219:公布1期临床试验数据
Biomea Fusion公司公布了其在研共价小分子menin抑制剂BMF-219治疗携带menin依赖性突变的复发/难治性急性髓系白血病(AML)患者的1期临床试验数据。在临床前研究中,BMF-219已在急性白血病细胞系中证实,除了menin本身外,它还能强效下调关键的致白血病基因。此外,BMF-219还在急性白血病、多发性骨髓瘤、弥漫性大B细胞淋巴瘤和慢性淋巴细胞白血病的多种体内外模型中显示出抗癌功效。
初步数据显示,在接受剂量水平4治疗的5例携带menin依赖性突变的复发/难治性AML患者中,有2例获得完全缓解。BMF-219的安全性特征支持进一步的剂量递增研究,目前剂量水平5队列的招募工作已经开始,以探索最佳的剂量。BMF-219的耐受性总体良好,未发现剂量限制性毒性,也未报告QTc延长。
BHV-7000:公布1期临床试验的初步数据
Biohaven公司公布了其用于癫痫和神经元过度兴奋的Kv7离子通道激活剂BHV-7000的1期临床试验的初步数据。结果显示,BHV-7000的药效学作用与文献中报道的抗惊厥药物(ASM)的效果相似,其中包括正在开发的对治疗癫痫有临床疗效的Kv7激活剂。初步数据表明,BHV-7000与其他ASM相比具有差异化和潜在的良好临床特征,Biohaven公司预计将在今年年底前提交完整的脑电图结果。此外,药代动力学数据支持2/3期临床试验采用每日一次的缓释制剂。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}