近日,《自然》杂志子刊Nature Reviews Drug Discovery发表了一篇综述文章,讨论了新兴的RNA靶向基因激活疗法,重点探讨其在临床转化中的机遇与挑战。
近年来,基于核酸的基因激活治疗模式受到了广泛关注,它能够针对性地调节基因表达,并对疾病的潜在遗传学成因进行干预。随着核酸化学和生物学的进步,基于RNA的机制特异性调节得以实现,为蛋白质上调提供了巨大机遇。然而,尽管过去数年间进行了大量研究,该领域的进展仍面临挑战。近日,《自然》杂志子刊Nature Reviews Drug Discovery发表了一篇综述文章,讨论了新兴的RNA靶向基因激活疗法,重点探讨其在临床转化中的机遇与挑战。

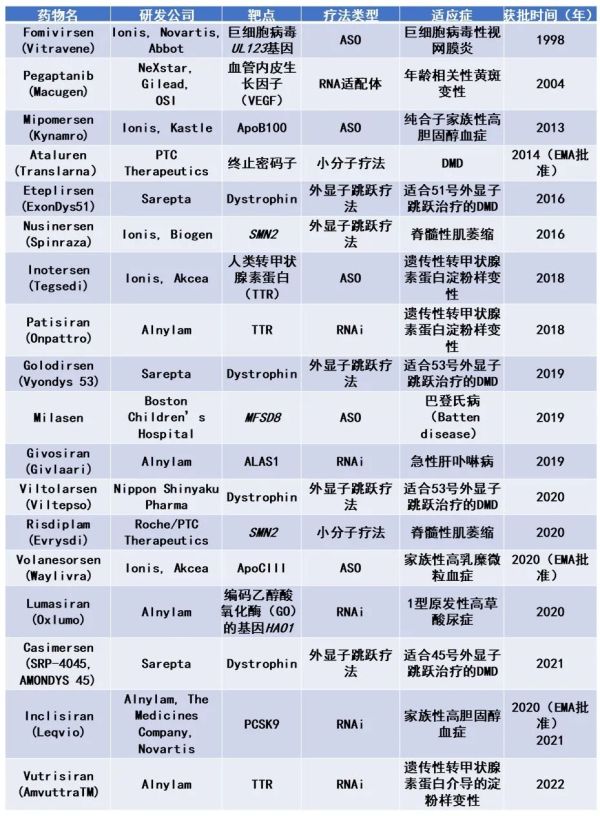
蛋白质上调是指增加细胞或组织中特定蛋白质的产生或丰度的过程。这可以通过调节细胞中蛋白质产生任何阶段的生物过程来实现,包括转录、剪接、翻译或翻译后修饰。蛋白质上调的目标是让疾病状态下缺乏或缺失的蛋白质恢复到正常水平,或增加具有治疗潜力的蛋白质水平。蛋白质上调有几种方法,包括小分子、肽和RNA靶向治疗。小分子和肽可以直接作用于蛋白质或其调节途径,以增加其产量或稳定性。然而,这些方法可能缺乏特异性,并且可能具有脱靶效应。另一方面,RNA靶向治疗是一种新兴的蛋白质上调方法,其中包括使用基于核酸的疗法(NBT)来调节RNA分子,如信使RNA(mRNA)或microRNA(miRNA),以激活基因的表达来增加特定蛋白产量。此外,RNA靶向治疗还可以通过使用反义寡核苷酸(ASO)或小干扰RNA(siRNA)降解抑制性RNA分子来实现蛋白增产。NBT是近年来备受关注的一种新兴治疗模式。与其他蛋白质上调方法相比,NBT有几个优势。其一,NBT具有高度特异性,只针对编码目标蛋白质的RNA分子。它们也可以被设计成具细胞类型特异性,靶向递送到特定的组织或器官。此外,NBT还可以被设计为短暂性疗法,让蛋白质可逆上调。NBT在蛋白质上调中最有前途的应用之一是解决由基因突变造成的蛋白质缺乏问题。许多遗传病是由于基因变异导致产生非功能性的蛋白或特定蛋白质数量不足,NBT可通过靶向RNA分子来增加功能性蛋白质的产量。经过数年的发展,已有18款NBT疗法获得美国FDA或欧洲药品管理局(EMA)的批准上市。▲获得美国FDA或EMA批准上市的NBT疗法(数据来源:参考资料[1])此外,另有多款NBT疗法已进入临床开发阶段,从治疗模式来看,现有的NBT主要包括以下三种类型:一些NBT可通过调节RNA剪接活动来增加目标蛋白水平,这种方法已成功用于治疗脊髓性肌萎缩症(SMA)——一种由SMN1基因功能缺失突变造成运动神经元生存蛋白(SMN)缺乏所引起的遗传病。FDA已经批准了RNA靶向疗法nusinesen用于治疗SMA。杜氏肌营养不良症(DMD)的治疗也迎来了经FDA批准的剪接转换寡核苷酸疗法:eteplirsen、golodisen、viltolarsen和casimersen,旨在治疗与外显子突变相关的DMD。治疗性mRNA递送是一种以mRNA作为活性成分的治疗方式。mRNA是一种将遗传信息从DNA传递到核糖体的分子,其所携带的遗传信息在核糖体中转化为蛋白质。治疗性mRNA递送涉及使用外源性mRNA来增加细胞或组织中特定蛋白质的产生。治疗性mRNA的递送在治疗由蛋白缺乏引起的疾病方面有几个潜在的应用。其一,它可作为蛋白质替代疗法,治疗以蛋白功能缺失或数量不足为特征的遗传性疾病。以Translate Bio(现已被赛诺菲收购)开发的MRT5005为例,该疗法通过雾化方式将编码功能完整的囊性纤维化跨膜传导调节因子(CFTR)的mRNA递送至肺上皮细胞,从而解决囊性纤维化的根本原因。治疗性mRNA递送也被用于疫苗的开发。mRNA疫苗通过向接种者体内传递编码病毒抗原的外源mRNA,然后由宿主细胞转化为抗原蛋白以触发免疫反应,从而防止接种者未来被病毒感染。最后,在癌症治疗中,将mRNA直接注入肿瘤,可诱导肿瘤靶向的免疫反应,以增强免疫治疗的效果。促进核糖体翻译的小分子是一类化合物,可以促进含有过早终止密码子(PTC)的mRNA分子翻译出全长蛋白质。PTC是导致蛋白质翻译提前终止的mRNA序列突变,这种突变会产生截断且通常无功能的蛋白质。促进核糖体翻译的小分子通过与核糖体相互作用来招募能够识别并结合PTC的近同源转运RNA(tRNA),这使得核糖体能够绕过PTC继续翻译,从而产生全长蛋白质。该机制的一个应用实例是由PTC Therapeutics开发的ataluren。Ataluren已在一些国家被批准用于治疗DMD。此外,还有一些小分子利用RNA分子中的“核糖开关”结构来改变其转录产物的构像,从而影响其细胞内功能。除了已经进入临床试验阶段的NBT外,大量新型NBT正在实验室中孕育。这些创新疗法尽管仍处于早期的研发阶段,距离实际临床应用还有一段距离,但其独特的作用机制具有广阔前景,有望变革现有的医疗治疗模式。miRNA是一类常见的非编码单链RNA,它们同样参与了基因表达调控。研究人员正在尝试通过合成miRNA的模拟物(promirs)和miRNA阻断剂(antagomir或antimir)来改变miRNA的活性,以上调目标蛋白水平。小激活RNA是一种可以激活基因表达的合成RNA分子,通过靶向基因的特定启动子区域并诱导其转录激活来上调基因表达。当前,由MiNA Therapeutics开发的saRNA疗法MTL-CEBPA正在作为一种补充疗法进行临床测试,以提高标准癌症治疗药物的疗效。MTL-CEBPA的作用机制可能涉及通过上调其靶转录因子CEBPA107来灭活免疫抑制性髓细胞。MTL-CEBPA与PD-1免疫检查点抑制剂帕博利珠单抗联合的1期试验结果显示,与基线相比,该组合疗法改善了肿瘤免疫抑制状况,并增强了肿瘤中细胞毒性T细胞的浸润。在试验中观察到了4名患者的客观缓解。已知NAT可抑制50-80%的基因位点的表达,因此靶向NAT的疗法为治疗需要上调蛋白水平的疾病提供了一种可行的策略。单链NAT特异性寡核苷酸(Antago-NAT)可特异性靶向脑源性神经营养因子BDNF基因位点中的NAT,在体外和体内诱导BDNF基因特异性上调。在临床前研究中,通过鼻内递送技术给药后,该疗法可以诱导大鼠大脑多个区域(包括深层结构)中BDNF蛋白上调。与脑室内和鞘内递送策略相比,鼻内给药是一种更安全、更便捷的寡核苷酸大脑递送方法。类似的疗法还有靶向SCN1A基因位点中NAT的Antago-NAT疗法CMP-SCN,SCN1A中的杂合突变导致Dravet综合征(一种罕见的儿童癫痫形式)的发生。在小鼠实验中,CMP-SCN诱导了SCN1A在体外和体内的特异性上调,并显著减少了Dravet综合征小鼠模型的癫痫发作。非人灵长类动物的临床前毒性研究表明,使用CMP-SCN治疗后,各脑区中SCN1A的mRNA和蛋白质显著增加,并且治疗的安全性良好。除了上述的疗法外,研究人员正在积极探索和开发不同的分子形式,以期将它们转化为NBT的治疗模式。这其中包括基于启动子相关RNA(pRNA)、增强子RNA(eRNA)和小胞浆RNA(seRNA)的疗法。此外,针对已知参与印记基因转录本沉默的非编码RNA、上游开放阅读框架、UTR调控元件、或是RNA聚腺苷酸化过程也成为了NBT领域的新兴研究方向。首先,当前NBT的一个共同缺点是它们无法穿过肠壁或血脑屏障,针对该挑战的应对策略是通过静脉内、皮下、脑内、侧脑室内或鞘内给药来解决。但这些方法是侵入性的(特别是对于输送到中枢神经系统),可能会对身体造成伤害。因此,研究人员正在研究开发新的给药和制剂技术。其次,NBT在晚期核内体中的滞留可能会影响治疗效果。一些早期的研究工作正在着眼于优化寡核苷酸的序列和化学性质,以及开发可以帮助NBT从核内体中释放的递送介质和化合物。此外,核酸分子可能具有脱靶效应,这可能导致意想不到的后果,如癌基因的激活或抑癌基因的抑制。因此亟需能够增加NBT特异性的策略。最后,NBT的药代动力学和药效学非常复杂,目前尚未被充分理解。现有的临床药代动力学数据很少,对其在动物研究中获得的药代动力学或药效学数据的理解也不够全面。总的来说,NBT为基因表达的特异性调控提供了全新的可能性。NBT拥有显著的优势,例如其特异性以及能够靶向“不可成药”靶点的潜力。尽管在NBT的开发和临床转化过程中依然存在一些挑战,但我们对于在未来的研究中克服这些问题保持乐观的态度。NBT在临床前和临床研究中已显示出了巨大前景,有希望引领对抗癌症、罕见病和病毒感染等多种疾病的新治疗方式。我们相信,随着研究的不断深入,NBT将成为我们对抗疾病的重要工具。






{replyUser1} 回复 {replyUser2}:{content}