每年耗费数百亿!如何提升癌症药物的研发成功率?
新型肿瘤药物的开发是一个成本高昂且充满挑战的过程,其中,高失败率为药物研发者带来了巨大的挑战。最近,JAMA子刊JAMA Network Open发表了一篇分析胰岛素样生长因子-1受体(IGF-1R)抑制剂研发状况的文章,并以此为例,深入解析了肿瘤药物在临床转化过程中的挑战,以及解决这些挑战的潜在方法。

在21世纪初,由于IGF-1R在细胞增殖、生长和存活中的关键作用,药物开发人员对其产生了浓厚的兴趣,纷纷投入该领域进行新药研究。该研究指出,16种IGF-1R抑制剂在近1.2万名患者中总计进行了183次临床试验,然而并没有任何一款药物得到了监管批准用于肿瘤的临床治疗。这些试验所消耗的资金估计达到了16亿美元。
更为关键的是,已公布的体内临床前数据中,其中有一半显示IGF-1R抑制剂对肿瘤生长的抑制率不足50%,这进一步暗示临床前数据的质量可能是肿瘤药物高失败率的关键因素。作者们也期望通过分析导致药物研发失败的因素,找到提高肿瘤药物开发成功率,并最终使患者受益的策略。
从IGF-1R抑制剂窥见新药研发的惊人成本投入
这项研究采用了横断面设计,以IGF-1R抑制剂的研发过程为案例,探索肿瘤药物开发过程中临床转化失败的成本及其原因。为了达到这一目的,研究人员深入挖掘了PubMed和ClinicalTrials.gov等公共数据库,确定了2000年1月1日至2021年7月31日期间,用于肿瘤治疗的IGF-1R抑制剂临床试验。为进一步了解这些试验的经济投入,他们还查阅了一些专业的商业数据库。在收集和整理了足够的数据后,研究人员对新型肿瘤药物在临床试验中失败的原因以及相关成本进行了详细的分析。此外,他们还利用PubMed检索了各种IGF-1R抑制剂的体内临床前数据,深入研究了其在临床前试验中抑制肿瘤生长的效果。
研究揭示,已有16种主要通过抑制IGF-1R发挥作用的疗法进入了临床研究阶段,其治疗模式涵盖了小分子药物、复合型细胞疗法及抗体。据资料显示,在这些基于IGF-1R抑制剂的治疗策略下,已经展开了183个临床试验,总共涉及约1.2万名患者,整体费用估计超过16亿美元。
进一步的数据分析展示,从2000年至2015年,IGF-1R抑制剂的临床试验数量根据其试验阶段(1-3期)有所波动。2003年,首次使用IGF-1R抑制剂figitumumab的1期临床试验启动,而首个3期试验则是在2008年启动。从2003年至2009年,每年启动的试验数量持续上升,但之后数量开始逐渐减少,并从2013年起锐减。
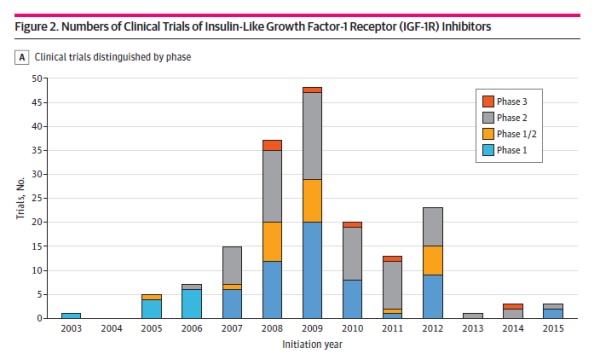
▲IGF-1R抑制剂临床试验数逐年变化图示(图片来源:参考资料[1])
值得注意的是,这项研究还指出,已发布的体内临床前数据中,有约一半显示IGF-1R抑制剂对肿瘤生长的抑制效果不足50%。这暗示临床前证据的不足可能是肿瘤药物临床试验高失败率的关键因素之一。
投入新药临床试验失败的原因究竟在哪,我们该怎么做?
该研究指出,IGF-1R抑制剂在临床试验中的的不良表现主要是因为它们缺少充足的临床疗效——这是获得肿瘤治疗监管批准的必要条件。不论是在哪家医药或生物技术公司的试验中,各种IGF-1R抑制剂均未能展现出对肿瘤的明显临床效益。
这些研究结果揭示了临床试验中的潜在核心问题。例如,当IGF-1R信号通路受到抑制时,可能有其他替代通路被激活,从而接替其功能。此外,在为临床试验选择受试者时,对预测性生物标记物的运用不足或未能恰当使用也可能是促成因素之一。通过深入的回顾性分析,研究者认为,临床试验的失败与缺少基于生物标记物的策略密切相关。

图片来源:123RF
关于IGF-1R抑制剂开发中所应用的临床前模型,一些观点认为它们未能准确捕捉到疾病的核心特征,也未能为将候选药物推向临床试验的决策提供有效指导。例如,从异种移植模型中得到的体内单一药物活性数据呈现出不一致的情况,其中有一半的研究显示肿瘤生长抑制率低于50%。
此外,大多数研究并没有考虑治疗结束后肿瘤的复发情况。尽管在临床前阶段的体内数据看似令人信服,但尚没有确凿的证据表明IGF-1R抑制剂在荷瘤小鼠模型中能实现长效治疗。虽然一些研究人员认为异种移植模型数据能预测IGF-1R抑制剂在临床上的表现,但到目前为止,这些抑制剂在临床试验中并未展现出明确的治疗效果。因此,目前的主要关注焦点应该是对靶标进行更为严格的验证,并对临床前模型进行进一步的优化和改进。
从药物研发成本的角度探讨,本研究发现183项IGF-1R试验所产生的研发费用累计达到16.30亿美元。在医药行业,每年约有500亿至600亿美元被投入到最终可能失败的癌症研发项目中。由于肿瘤学领域的试验密集度高,许多试验可能存在重复性,甚至可能是不必要的。以IGF-1R抑制剂为例,尽管有16家公司投入了巨资进行临床试验,最终都未能获得成功。这样的现象可能与对新药的期望过高、行业竞争的加剧,以及对不断更新药物研发管线的持续压力有关。
图片来源:123RF
对于这种短期内在一个热点领域进行大量“跟风研究”的现象,DTx Pharma的创始人兼首席执行官Arthur Suckow博士在参加药明康德BOLD论坛活动中曾指出:“许多公司在不同的地方做着同样的事情。我不知道该如何进行整合,但这会导致资金使用效率低下,因为有很多重复的工作正在进行。”
未来,对肿瘤学领域这种竞争导致的成本和后果进行深入的研究将是一个富有意义的研究方向。从IGF-1R抑制剂项目的经验中,我们至少可以汲取三个重要教训:首先,抗癌药物在研发前应经历严格的证据筛选;其次,技术应保持多样化,以避免对某一特定机制的过度依赖;最后,当临床研发失败时,应进行深入的原因分析。
还有一些因素对新药研发效率有着不可忽视的影响。比如CHARM Therapeutics的创始人、首席执行官Laksh Aithani先生曾在药明康德系列访谈中提到了数据共享的重要性,他认为在临床前阶段,更好地收集数据,并将之整理、标准化、整合,然后在不同公司和学术界之间共享数据可以提高研发效率。

此外,促成研究和开发团队工作人员的密切合作,也被一些业内人士认为是提升医药行业的研发效率的抓手之一。Sonoma Biotherapeutics的首席执行官Jeffrey Bluestone博士在谈到如何提升新药研发效率时表示,研发效率和行业生产力在总体上取决于两个方面——在研的治疗模式是什么、以及它是如何被测试的,研发效率实际上是研究和开发之间的联系。在他看来,我们越是能够让研究人员、早期发现科学家、以及制造团队之间进行密切合作,我们就越能开发出有效和可靠的治疗方法。

最后,临床前模型的不足无疑会影响新药开发的成功率。CAMP4 Therapeutics的首席执行官Josh Mendel-Brehm先生也曾在药明康德举办的BOLD系列论坛活动中强调了临床前模型在新药研发中的重要作用。他表示,药物的发现和开发始于靶点的确定,随后研究人员设计药物并在尽可能多的模型中进行测试,然后进入临床试验,从根本上验证初步假设。因此,在他看来,无论是生物体模型、组织芯片、或是其他更接近真实人体情境、能更准确预测药物在人体中效果的模型,其出现都是非常有价值的。如果我们能够从一开始就有更高的成功率,就无需再追求第二代、第三代或第四代药物的研发。因此,我们应该努力确保第一次尝试就能取得成功。他坚信,优化的临床试验设计,和更先进的研究方法会大有裨益。
总之,通过深入探讨新药分子在临床转化中遭遇的障碍以及其研发的成本,我们不仅能更加明智地筛选出具有高潜力的药物候选者,从而提高研发效率,同时有助于我们创新和完善研发策略。这些策略的核心是:加强靶点的验证,优化临床前的试验模型,增加药物形态与技术手段的多样性,以及更加高效地配置研发资源。实践这些策略有望显著降低癌症等重大疾病的致死率,减少临床试验的失败率并且避免患者暴露于潜在的药物毒性。随着我们在新药研发领域不断探索,预期成功开发新药的机会将逐渐上升。这将使我们能够更快地将创新疗法引入市场,同时降低研发成本,并为患者提供真正有益的治疗,进一步减轻全球健康负担。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}