日前,行业媒体Evaluate发布的年度报告中,着重介绍了10款值得关注的在研新药。根据Evaluate的评估,这些在研项目均具有成为重磅疗法的潜力。值得一提的是,这10款潜在重磅疗法中只有两款抗癌疗法,它们治疗的疾病呈多元化趋势,其中,治疗心血管代谢疾病的在研新药有三款上榜,治疗神经系统疾病的两款在研新药上榜。下面我们来看一看这些潜在重磅疗法将有望造福哪些患者。
Sotatercept是一款潜在“first-in-class”IIA型激活素受体(ActRIIA)融合蛋白。它将ActRIIA经过改造的细胞外域与抗体的Fc端融合在一起,可以阻断激活素与细胞膜上的受体结合,从而降低激活素介导的信号传导。它是首款获得突破性疗法认定的肺动脉高压在研疗法。今年3月公布的3期临床试验结果显示,在肺动脉高压患者中,sotatercept在治疗24周后将患者的6分钟行走距离(6MWD)与基线相比提高40.8米,达到试验主要终点。此外,与安慰剂相比,在中位随访时间为32.7周时,它将患者的疾病临床恶化或死亡风险降低84%。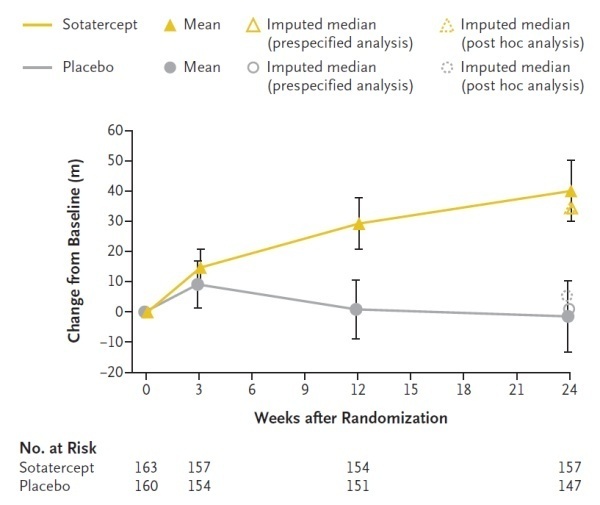
▲Sotatercept显著改善肺动脉高压患者的6分钟行走距离(图片来源:参考资料[3])
目前,sotatercept用于治疗肺动脉高压的新药申请正在接受FDA的审评,默沙东表示,sotatercept具有和重磅抗癌疗法Keytruda一样成为基石性疗法的潜力。Datopotamab deruxtecan(第一三共/阿斯利康)
Datopotamab deruxtecan是一种由人源化、靶向人滋养层细胞表面糖蛋白抗原2(Trop2)的单克隆抗体与创新DNA拓扑异构酶I抑制剂(DXd)连接的抗体偶联药物(ADC)。DXd具有独特的作用机制,与常见化疗药物伊立替康(irinotecan)相比,活性提高10倍。而且此药物具有很强渗透细胞膜的能力,让它们在杀伤吞入ADC的癌细胞之后,能够杀死附近的癌细胞,产生“旁观者效应”(bystander effect)。今年7月,第一三共/阿斯利康宣布datopotamab deruxtecan在治疗晚期非小细胞肺癌(NSCLC)患者的3期临床试验中达到无进展生存期(PFS)的主要终点。与标准化疗相比,在经治晚期或转移性NSCLC患者中显著提高PFS。在中期评估时,总生存期(OS)数据尚未成熟。Datopotamab deruxtecan目前在12项临床试验中接受检验,包括乳腺癌等多种癌症类型。
CagriSema包含了GLP-1受体激动剂司美格鲁肽(semaglutide)与长效胰淀素(amylin)类似物cagrilintide。GLP-1是调控血糖的激素,而胰淀素是一种与胰岛素共同分泌的多肽,它通过调节饱腹感的信号通路降低食物摄入。
去年8月公布的2期临床试验结果显示,CagriSema与司美格鲁肽或cagrilintide单药治疗相比,在体重超重的2型糖尿病患者中,导致糖化血红蛋白水平(HbA1c)和体重更大幅度的下降。经过32周的治疗后,CagriSema、司美格鲁肽与cagrilintide组病患的HbA1c分别下降2.18、1.79与0.93个百分点。此外,CagriSema、司美格鲁肽与cagrilintide组病患的体重分别下降了15.6%、5.1%与8.1%。目前CagriSema治疗超重或肥胖患者的3期临床试验已经展开,预计在2024或2025年获得结果。Donanemab与名为N3pG的淀粉样蛋白亚型特异性结合,通过靶向这一亚型,donanemab能够特异性地与大脑中的淀粉样斑块相结合,从而促进淀粉样斑块的清除。今年7月公布的3期临床试验TRAILBLAZER-ALZ 2结果显示,donanemab可显著减缓具有阿尔茨海默病早期症状患者的认知与功能下降、延缓疾病进展。亚群分析显示,处于疾病最早阶段的受试者获益更为显著,与安慰剂相比,其认知与功能下降减缓达60%。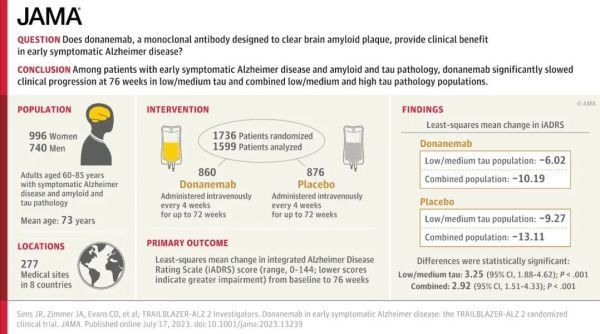
▲TRAILBLAZER-ALZ 2试验设计与结果摘要(图片来源:参考资料[4])
礼来已在今年第二季度完成向美国FDA上市申请的递交,并预计在今年年底获得审评结果。KarXT(Karuna Therapeutics)
KarXT由xanomeline和trospium chloride两种有效成分构成,旨在激活大脑中的毒蕈碱型乙酰胆碱受体的同时,减少对外周毒蕈碱型乙酰胆碱受体的作用。通过刺激毒蕈碱受体M1和M4受体,受体激动剂xanomeline可缓解负面症状,如冷漠、社会驱动力减少、提高认知能力,并对改善其它精神症状,如幻觉和妄想很有帮助。而季铵盐化合物trospium chloride为毒蕈碱受体拮抗剂,可抑制xanomeline于外周神经中的副作用。再鼎公司拥有这款创新疗法在大中华区的研发权益。值得提及的是,这两种药物经不同的肝脏酶代谢,意味着药物间的相互作用可能更少。此外,Karuna Therapeutics公司时任首席执行官Steve Paul博士在2020年于药明康德全球论坛时曾说道:“我们非常关注精神分裂症疾病,这是一种非常复杂的疾病。在这一领域,自上世纪50年代氯丙嗪被发现以来,真正的创新几乎不存在。现在,这一切开始改变。人类对大脑的理解产生了根本性的变化,了解了能够提高阿尔茨海默病风险的基因,对精神病发作和抑郁症生理学信号通路也有了更深刻认识。正因为如此,我们能够以更有效的方式对疾病进行干预。”
▲Steve Paul博士在2020药明康德全球论坛上分享创新药物开发的洞见
今年3月,KarXT在名为EMERGENT-3的3期临床试验中达到主要终点,接受治疗5周后,KarXT组精神分裂症患者的阳性和阴性症状量表(PANSS)总分与安慰剂组相比,获得统计显著并具有临床意义的改善。KarXT组的PANSS降低20.6分,比安慰剂组多减少8.4分(p<0.0001)。
Karuna Therapeutics预计在今年第三季度向美国FDA递交新药申请。mRNA-1647是一款由6种mRNA构成的巨细胞病毒(CMV)疫苗,5种mRNA编码CMV与细胞膜结合的五聚体复合物的不同亚基,一种mRNA编码糖蛋白B(gB)。这些蛋白对CMV感染上皮细胞和成纤维细胞非常重要。mRNA-1647旨在激发对这些蛋白的免疫反应,从而预防CMV感染。育龄期女性CMV预防是一项亟待解决的临床需求。CMV病毒属于疱疹病毒家族,这一病毒感染通常症状轻微或者没有症状,世界上大部分成人都被CMV感染过,它可以一直潜伏在宿主的细胞内。然而,世界上1/150的新生儿会出现先天性CMV感染,它是造成先天缺陷的首要感染性原因。大约20%受到感染的婴儿会产生长期缺陷,25%受到感染的婴儿会出现听力丧失。目前,mRNA-1647预防CMV感染的3期临床试验已经完成80%参与者注册,Moderna计划在年底之前完成全部参与者的注册。
Iptacopan是一种特异性靶向补体因子B的潜在“first-in-class”抑制剂,该靶点是替代补体通路的关键蛋白。Iptacopan在C5补体通路的上游发挥作用,既能阻止PNH的血管内溶血,也可以防止血管外溶血的发生。今年4月,诺华宣布iptacopan在治疗此前未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)患者的3期临床试验中达到主要终点。约92.2%的患者在接受iptacopan治疗24周后,在不需要输血的情况下血红蛋白水平提高2 g/dL以上。Iptacopan是诺华公司的重点开发项目之一,目前正针对多种其他补体介导性疾病(CMDs)进行临床开发,包括C3肾小球病(C3G)、IgA肾病(IgAN)、非典型溶血性尿毒症综合症(aHUS)、狼疮性肾炎(LN)以及血液疾病免疫性血小板减少性紫癜(ITP)和冷凝集素病(CAD)。Resmetirom(Madrigal Pharmaceuticals)
Resmetirom是一种潜在“first-in-class”甲状腺激素受体(THR)-β选择性激动剂,旨在靶向非酒精性脂肪性肝炎(NASH)的关键基础病因。甲状腺激素通过激活肝细胞中的β受体,在肝功能中发挥核心作用,影响从血清胆固醇和甘油三酯水平,到肝脏中脂肪病理性积聚等一系列健康参数。THR-β受体在肝脏中的作用是肝脏正常功能的关键。Resmetirom具有高选择性,能够避免激活介导肝脏外(包括心脏和骨骼)甲状腺激素活性的THR-α受体,并且在肝脏部位被特异性摄取。之前的试验证实resmetirom的安全性,即对THR-α受体无活性,对骨骼或心脏参数无影响,同时不影响甲状腺激素通路的其它激素。它已经获得美国FDA授予的突破性疗法认定,用于治疗NASH。去年12月,Madrigal Pharmaceuticals公司宣布关键性临床试验MAESTRO-NASH达到组织学主要终点。更多接受resmetirom治疗的患者获得NASH症状缓解,非酒精性脂肪肝活动评分(NAS)降低≥2分,且肝纤维化无恶化;以及肝纤维化至少改善一个阶段,且NAS无恶化。Madrigal Pharmaceuticals在今年7月宣布,已经完成向美国FDA滚动提交resmetirom的新药申请,用于治疗伴肝纤维化的NASH成人患者,有望成为首款获批NASH疗法。
Aficamten是一款选择性小分子心肌肌球蛋白抑制剂,旨在抑制与肥厚型心肌病(HCM)相关的心肌过度收缩。在临床前模型中,aficamten通过在一个独特的选择性别构结合位点直接与心肌肌球蛋白结合,从而阻止肌球蛋白进入产力状态,降低心肌收缩力。Aficamten已经获得了美国FDA授予治疗出现症状的梗阻性HCM的突破性疗法认定。目前,它正在名为SEQUOIA-HCM的关键性3期临床试验中接受评估,预计在今年第四季度获得结果。同时,Cytokinetics公司也已经开展另一项3期临床试验,在出现症状的梗阻性HCM患者中比较aficamten与肾上腺β受体阻断剂metoprolol的效果。Tiragolumab是一款靶向TIGIT的单克隆抗体。TIGIT的全称是T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with Ig and ITIM domains),是癌症免疫学领域广受关注的免疫检查点蛋白。同时阻断PD-1和TIGIT信号通路,能够产生协同作用,增强肿瘤内CD8阳性T细胞的抗癌活性。
今年8月,罗氏旗下基因泰克公司宣布,tiragolumab与PD-L1抑制剂Tecentriq联用,在治疗PD-L1高表达的局部晚期或转移性非小细胞肺癌患者的3期临床试验中,在第二次中期分析时显示出OS改善的趋势。接受tiragolumab与Tecentriq联合疗法患者的中位总生存期估计值为22.9个月(95% CI:17.5-NE),Tecentriq单药治疗组为16.7个月(95% CI:14.6-20.2),风险比(HR)为0.81(95% CI:0.63-1.03)。不过目前数据尚未成熟,与Tecentriq单药治疗相比,未达到统计学显著差异。基因泰克将持续进行该试验直至完成最终OS分析。在今年的美国临床肿瘤学会(ASCO)年会上公布的1b/2期临床试验结果显示,tiragolumab与目前的一线肝癌疗法Tecentriq/Avastin联用,显著提高晚期肝细胞癌患者的客观缓解率。Tiragolumab三联疗法组的客观缓解率(ORR)为42.5%,是对照组(11%)的接近4倍。Tiragolumab三联疗法组的中位PFS为11.1个月,对照组为4.2个月。在一线疗法中加入tiragolumab让疾病进展和死亡风险降低58%。







{replyUser1} 回复 {replyUser2}:{content}