《自然》子刊:从全球254款临床期CAR-T疗法,看新一代疗法创新走向何方?
自首款CAR-T细胞疗法在2017年获得FDA批准以来,总计8款CAR-T疗法已经获得全球监管单位的批准。这些疗法在某些血液癌症治疗中表现出变革性的疗效。然而,CAR-T细胞疗法应用的拓展,以及在实体瘤和自身免疫性疾病方面的应用仍然面对着安全性、疗效和制造方面的多重挑战。新一代CAR-T技术平台能够在解决这些挑战方面有所突破吗?日前,《自然》子刊Nature Reviews Drug Discovery上发表的一篇文章通过对目前处于临床开发阶段的超过200项CAR-T研发项目的分析,对这一问题进行了探讨。

下一代CAR-T疗法创新的两大方向
CAR-T疗法的创新可以归类为两个大方向:细胞来源和工程化设计策略。将细胞来源从患者自身转向可更为规模化生产的同种异体来源,以至最终在患者体内直接制造CAR-T细胞,可能帮助解决疗法制造和给药方面的局限性,并且提高安全性和缓解的持久性。
与此同时,基因组编辑和合成生物学工具的应用让研究人员可以更精准地调控CAR-T细胞在何时何地激活,以及活性的强度。这些技术可能改善疗法的安全性和效力。这些工程化设计策略的例子包括逻辑门控(logic-gated),分子开关(on/off),可转换靶点,多靶点和武装(armoured)系统。下图总结了这些创新策略对CAR-T疗法安全性、效力、制造成本和速度以及给药便捷性的影响。
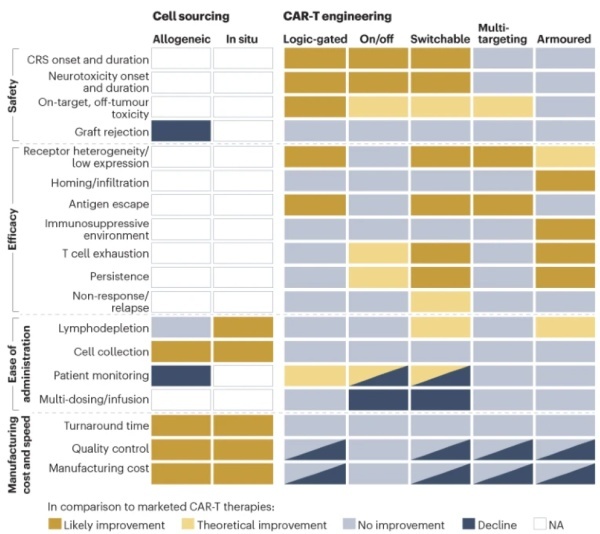
▲CAR-T疗法创新的影响(图片来源:参考资料[1])
具体来说,在安全性方面,分子开关、可转换靶点和逻辑门控平台可能提高CAR-T疗法的安全性,扩展在身体健康情况较差患者中CAR-T疗法的可及性。比如,Calibr和Scripps研究所联合开发的CAR-T疗法CLBR001是一款可以根据衔接蛋白的不同类型,靶向不同靶点的CAR-T疗法。CLBR001表面表达的嵌合抗原受体识别衔接蛋白的一端,衔接蛋白的另一端与肿瘤特异性靶点结合。只有向患者体内输注衔接蛋白后CLBR001才会被激活。
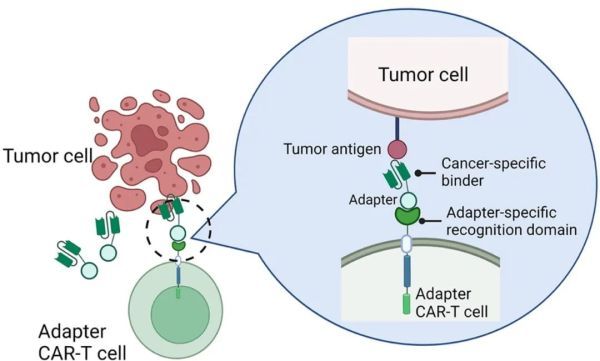
▲可控CAR-T疗法作用机制(图片来源:参考资料[3])
不过,这种改善安全性的策略需要患者在医院环境下接受衔接蛋白输注,这可能增加患者的负担,因此它们可能更适用于对安全性要求更高的患者,比如健康状况不佳的血液癌症患者。
在提高疗效方面,将其它蛋白、配体或细胞因子与CAR共同表达的武装策略在治疗实体瘤时可能改善CAR-T细胞的靶向和浸润能力,并且帮助它们克服免疫抑制性肿瘤微环境。而同时靶向多个靶点的CAR-T细胞可以解决肿瘤细胞异质性和抗原逃逸的挑战,让CAR-T疗法覆盖更多肿瘤类型,并且潜在提供更持久的抗癌活性。比如,亘喜生物(Gracell)公司的GC012F是同时靶向B细胞成熟抗原和CD19的CAR-T疗法。在今年ASCO年会上发布的最新临床试验数据显示,复发/难治性多发性骨髓瘤患者的总缓解率为93.1%,100%的患者达到微小残留病灶(MRD)阴性。中位无进展生存期(PFS)为38.0个月。
虽然这类提高疗效的策略适合用于针对目前缺乏有效疗法的实体瘤,不过它们未能解决目前疗法的安全性问题,包括CRS、神经毒性等毒副作用。
在患者体内直接制造CAR-T细胞的策略可以让治疗在门诊环境中进行,患者不需要住院,因此可能增加接受治疗的患者数量。不过病毒载体的免疫原性,以及如何控制CAR-T细胞的生产和避免相关毒性,仍然是限制其临床应用的障碍。
全球CAR-T细胞疗法管线一览
文章作者对全球处于临床开发阶段的254款不同CAR-T疗法的分析显示,大多数研发项目聚焦于传统的单靶点自体细胞疗法,不过越来越多的新一代CAR-T疗法正在进入临床开发阶段。以细胞来源划分,81%的临床期疗法使用来自患者的自体细胞,19%使用同种异体策略,目前尚未有直接在患者体内生成CAR-T细胞的研发项目进入临床阶段。不过值得一提的是,Umoja公司最近公布了直接在非人灵长类动物体内生成CAR-T细胞的临床前实验结果。该公司基于第三代慢病毒载体的VivoVec技术平台能够在非人灵长类动物体内有效和持久地生成靶向CD20的CAR-T细胞。
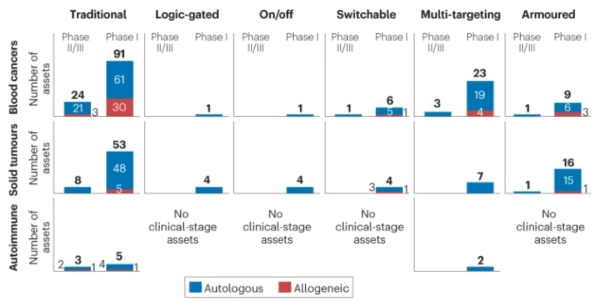
▲CAR-T疗法管线一览(图片来源:参考资料[1])
展望未来
作者表示,随着未来几年里更多临床试验数据的公布,不同CAR-T技术的风险将会降低。没有一种单一的策略可以解决所有问题,解锁CAR-T细胞疗法在实体瘤和自身免疫性疾病领域的应用需要在细胞来源和细胞工程化改造方面的不同创新的组合。有些创新可能具有互补效应(比如体内生成CAR-T疗法与可转换靶点技术联用),而其它创新组合可能导致更强的毒性(比如体内生成CAR-T疗法与武装策略联用)。选择哪些技术进行组合需要研究人员重新审视特定疾病领域的基本特征,深入理解特定患者群体的未竟需求,澄清应该聚焦于哪个方面才能解决关键性未竟需求。这样才能有的放矢地投资相关下一代技术平台。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}