随着像是生物制品与细胞基因疗法等新兴药物模式的兴起,小分子药物曾一度被认为即将过时。然而十多年过去了,事实证明随着药物发现的进展,小分子药物非但没有过时,反而迎来前所未有的复兴。日前美国化学会(ACS)旗下的C&EN网站发布的观点文章更称现今是开发创新小分子药物的绝佳时刻。药明康德内容团队将介绍相关内容,并结合公开资料,向读者介绍近期小分子药物开发的新趋势。
得力于生物科技的迅速发展,许多生物医药公司现今得以有效率且经济的方式生产不同类型的生物制品,包含大型多肽、重组蛋白、融合蛋白、单克隆抗体、抗体偶联药物(ADC)和疫苗。这些进展使得部分人士以为有超过百年历史的小分子药物将逐渐被这些新模式药物所取代。然而实际上,技术、合成方法学和生物制药研究等的进步同时也为创新小分子药物开辟更多的机会。根据2021年发布于Medicine in Drug Discovery的一篇观点文章,在全球范围内的上市药物中,有高达约90%属于小分子药物。
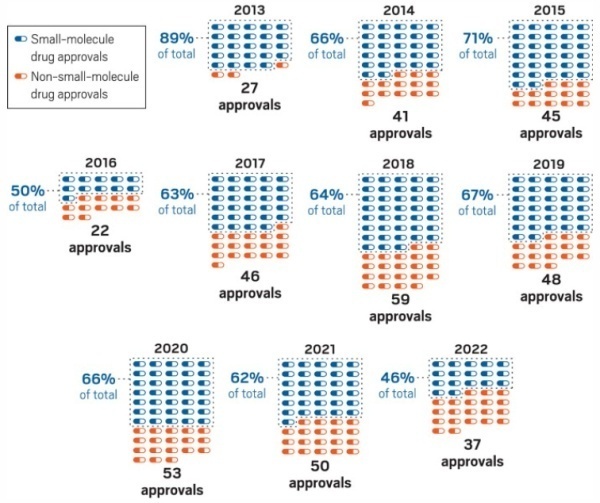
此外,小分子药物的许多优势也使得其在治疗上有着无可取代的地位。这包含大部分的小分子药物能够穿透细胞膜以靶向细胞内蛋白,且具口服的生物利用性,可以直接、有效率的方式将药物递送给病患。此外,与生物制品相比,小分子药物药代动力学与药效学特性更具预测性、不具免疫原性,以及其高稳定性与口服特征,皆有助于简化药物开发流程并增加病患的服药依从性。美国FDA的数据显示,小分子在药典中继续发挥着至关重要的作用。在2017年-2022年美国FDA批准的293个新化学实体中,有182个是小分子药物。▲美国FDA在已过10年当中批准上市药物中的小分子药物占比(图片来源:参考资料[1])小分子药物最初的开发多是依从锁-钥(lock-and-key)原理,即小分子拮抗剂就像一把钥匙,可以很好地插入锁(靶蛋白的活性口袋)当中,但却没有正确的形状来转动锁。当这把钥匙(拮抗剂)插入锁中时,正确的钥匙(激动剂)不能插入同一把锁,因此达到抑制靶蛋白的目的。而由于许多蛋白并不具可被靶向的口袋,因此难以根据其结构设计相对应的小分子对其进行调控。然而,共价抑制剂和诱导接近分子科技的进展使得研究人员得以超越锁-钥原理来靶向以往被认为“不可成药”的蛋白。这些创新小分子模式包含:共价药物包含一个轻度反应的官能团可与蛋白靶标形成共价键,除了参与药物结合的非共价相互作用外,还具有额外的亲和力。虽然共价药物用于治疗疾病已有一个多世纪的历史,然而由于这些反应分子干扰药物开发的生物测定过程,以及潜在缺乏化学反应的选择性,使得这类药物的开发裹足不前。但近期促进共价药物合理设计科技的进展打破了此一限制。如用于治疗各种癌症的共价表皮生长因子受体(EGFR)和布鲁顿酪氨酸激酶(BTK)抑制剂所证明的,在现有配体中有目的地添加活性官能团可以实现对靶蛋白的强效和选择性抑制。此外,通过"亲电子优先(electrophile-first)"方法鉴定共价配体也导致更多共价药物的发现。加州大学旧金山分校的Kevan Shokat教授及其团队的工作就是一个引人注目的例子。2013年,该团队发现了一种药物可与致癌KRAS突变体中的半胱氨酸共价结合并抑制该蛋白质的方法。如今,共价药物不仅可以靶向半胱氨酸,还可以靶向许多其他反应性氨基酸侧链。靶向蛋白降解是一种新的药物发现方法,可以彻底消除蛋白质,而不仅仅是抑制它们的活性。TPD的工作原理是利用细胞自身的蛋白质清除机制,即蛋白酶体和溶酶体途径,选择性地降解致病蛋白质。通过靶向蛋白降解原理开发的药物类型主要包含:
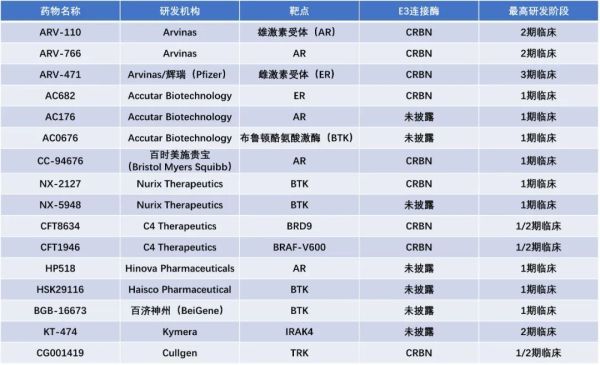
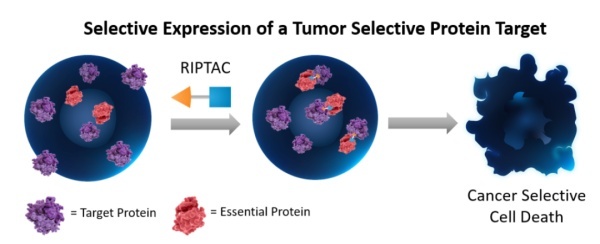
PROTACs由两个配体组成,它们通过一个连接子相连:一个配体专门与目标蛋白结合,而另一个配体则负责与E3连接酶结合。当目标蛋白和E3连接酶被招募到足够近的距离时,后者将催化目标蛋白的泛素化过程,进而导致其被蛋白酶体降解。虽然目前尚未有PROTAC药物获监管单位批准,但已有多款候选药物进入临床开发阶段。其中由辉瑞(Pfizer)与Arvinas公司共同开发的靶向雌激素受体(ER)的ARV-471表现出潜在“best-in-class”雌激素受体降解剂的潜力,在平均接受过5种前期疗法治疗的ER阳性、HER2阴性乳腺癌患者中,ARV-471能够显著降低患者肿瘤组织中的ER表达水平,平均将ER水平降低62%,最多降低接近90%。目前,ARV-471已进入3期临床研究。▲截至2023年9月已进入临床开发阶段的口服PROTAC疗法(药明康德内容团队制图,数据来源:参考资料[7])RIPTAC的一端可以与肿瘤细胞中高度表达的蛋白相结合,而另一端与细胞内和细胞生存紧密相关的蛋白结合。它们构成的三元复合体会抑制维持细胞生存蛋白的功能,从而导致肿瘤细胞的死亡。而健康细胞因为蛋白表达水平不高,不会被RIPTAC分子杀死。在今年美国癌症研究协会(AACR)会议上,Halda Therapeutics所开发的一款RIPTAC显示能够在雄激素受体发生突变的情况下仍能与两种预期蛋白结合,且药物可以口服方式给予。▲RIPTAC分子的作用机制(图片来源:参考资料[8])
LYTAC分子可以同时结合胞外蛋白或膜蛋白的胞外结构域,以及细胞表面的溶酶体靶向受体而形成三元复合物,并通过内吞作用(endocytosis)导致蛋白质的内化与降解。由于细胞外蛋白和膜蛋白占所有编码蛋白约40%,并且是神经退行性疾病、自身免疫性疾病和癌症的关键因素,因此拥有不同作用机制的LYTAC分子是PROTAC类药物的潜在良好互补,也是生物医药界亟欲探索、开发的新兴疗法。分子胶化合物是一种独特的小分子,可以通过在结合后降解、稳定或激活靶蛋白来改变其蛋白质-蛋白质相互作用(PPI)和相互作用组。与PROTAC药物相比,分子胶拥有较低的分子量,这使得这类以药物更容易进入细胞且得以在更低剂量产生疗效。这类药物被广泛看好,许多开发分子胶的生物科技公司与大药企签署合作协议。例如,Proxygen与德国默克(Merck KGaA)和默沙东(MSD)在去年签署了开发分子胶降解剂的协议。而Monte Rosa Therapeutics公司则在这个月与罗氏(Roche)达成合作,将共同开发靶向癌症和神经疾病致病蛋白的分子胶药物,这些靶标之前被认为是“不可成药”的。小分子研究的一个关键领域是识别和开发能够靶向RNA的分子实体。RNA发挥着许多生物学作用,包括聚合酶反应的调节、病毒感染以及基因表达等。干扰RNA执行这些功能的小分子将有助于治疗相关疾病。长期以来,RNA被认为是不可成药的,但研究人员现在知道RNA呈现3D结构,这为小分子相互作用创造结合位点。其中一家致力于RNA靶向药物开发的公司是Arrakis Therapeutics,该公司正在研究多种沉默RNA的方法,包括开发可与多核苷酸共价结合的药物,以及通过与RNA调控部位结合以修饰其生物学特性,进而诱导RNA降解。小分子药物开发技术的飞跃始于20世纪80年代结构生物学的进步,包括冷冻电子显微镜和高分辨率X射线晶体学技术的发展,这使得科学家能够以原子细节可视化生物学。此外生物信息学筛选和测定科技的进步也有助于确认蛋白质相互作用的位点。此外,基因筛查科技的发展也有助于识别基因和疾病之间的新联系,进而发现新的药物靶点。而基因测序的进展也加强了RNA靶向分子的开发。而近期小分子药物开发的飞速进展的主要原因之一是DNA编码化合库(DNA-Encoded Library,DEL)平台的开发。DEL是一种小分子文库,其中的小分子与独特的DNA标签耦合,这些标签可作为得以放大的识别条形码。得益于DNA相容反应、选择方法、下一代测序和数据分析方面的进步,DEL技术可以构建和筛选前所未有大小的文库,从而实现高通量、快速、高效的蛋白质-小分子相互作用鉴定与识别。DEL最大的优势是大大降低了成本和时间,只需在一根试管里就可以进行百亿级别的小分子筛选;通过解码,能够实现短时间内高效产生大量DEL信息,提供给下游进行信息分析,获得蛋白质的化学指征。据研究,在过去通过传统方法创建和研究包含100万个化合物文库需要花费4亿至20亿美元,而通过DEL平台,则可以用约15万美元的成本开发8亿种化合物。因此,DEL平台的开发大幅加速小分子药物的开发。
小分子药物开发正迎来新一波的复兴,但鉴于多种疾病的生物学复杂性,很难有一类药物得以适用于所有疾病的治疗。我们需要多样化的治疗选择,以鸡尾酒的形式共同发挥作用,才能真正提高临床疗效或效益。然而无论是开发何种治疗模式,我们都需要在医学与科技上有不断的突破与进展才能持续造福患者。正如同Kevan Shokat教授在接受药明康德团队“BOLD:创新引领,勇赴未来”活动采访时表示,“在药物发现中,制定规则意味着只发现遵循规则的东西。但事实上,往往是机缘巧合、规则破坏者打开了整个领域。寻求意想不到的事情可能会让我们在寻找有效药物方面取得下一个重大突破。”让我们期待无论是小分子药物或是其他新兴疗法,科学家们都能够跳脱现有框架与限制,持续实现自我挑战、开发创新疗法以在临床上实际造福患者。



{replyUser1} 回复 {replyUser2}:{content}