抗体工程传奇:他的发现拯救数百万患者于水火
格雷戈里·温特(Gregory P. Winter)爵士是一名英国生物化学家,以开发出第一批人源化抗体、研究抗体定向演化以及应用噬菌体展示技术开发全人源治疗性抗体而闻名。为推动科学发现的临床转化、促进新型治疗药物的开发,温特爵士先后创立了3家生物技术公司。他使用噬菌体展示技术开发的首个用于人类的全人源抗体——阿达木单抗(adalimumab)于2002年获批上市,拯救了全球数百万深陷疾病泥沼的类风湿关节炎患者,并大大改善了此类患者的残疾率。为了表彰温特爵士在抗体工程领域的突出贡献,诺贝尔奖委员会在2018年授予其诺贝尔化学奖。
在今天的文章里,药明康德内容团队将结合公开资料,带大家更加深入地了解这位不断在人生各阶段寻求新突破、以科学力量造福人间的杰出科学家。

▲Gregory P. Winter博士(图片来源:药明康德内容团队制作)
从未设想过除科学探索外的道路
格雷戈里·温特于1951年出生在英国,7岁以前,他都在气候温暖的西非度过。回到英国后,他在皇家文法学校读中学,也是在这所学校中,他开始对化学和生物学产生了兴趣。1973年,温特获得了自然科学学士学位,顺利从剑桥大学三一学院毕业,随后便遇到了对他的职业生涯产生了巨大影响的两位科学家——布莱恩·哈特利(Brian Hartley)教授和大卫·布劳(David Blow)教授。
布劳教授曾在暑期带着温特这个“临时学生”搭建了一个胰蛋白酶的展示模型,在这个过程中,温特第一次产生了对蛋白质结构和机制的兴趣。而哈特利教授则是使温特走上分子生物学研究道路的关键人物。那时,哈特利教授担任着三一学院本科学习主任的职务,在他极富感染力的劝说下,温特最终决定在哈特利教授指导的剑桥医学研究委员会(MRC)分子生物学实验室(LMB)攻读博士学位,然后于1976年获得了蛋白质化学的博士学位。
1981年,温特在伦敦帝国理工学院和剑桥遗传学研究所获得博士后奖学金后,重新回到了MRC分子生物学实验室,正式开启了他的职业生涯。
除了科学探索和技术开发外,温特似乎从未设想过其它的职业道路。在一次采访中他表示,自己一辈子都在和科学和技术打交道,如果没有选择研究科学,他真的不知道会从事什么工作。
踏上抗体人源化的征途
1980年代初,在研究了基因突变与蛋白质功能之间的关系后,温特将研究重点放在了抗体的定点诱变上,这种技术通过在抗体基因中有选择性地引入点突变,可以增强抗体与抗原的结合亲和力。
有一段时间,温特因意外造成右臂脱臼,暂时没办法做实验,他就只能在电脑上研究抗体的结构。现在我们都知道,抗体的结构由可变区和框架区组成,抗体可变区的高度多态性使抗体能够识别出几乎无穷多的不同抗原,而框架区则为抗体的整体结构提供了支持和稳定性。但在那时,这些概念都还仅仅是猜测。
通过对抗体结构的仔细研究,温特认为这个猜测可能就是真相,抗体与抗原的结合位点也有非常大的可能就在抗体的可变区上。随后他立即联想到,如果把来源于动物抗体的可变区嵌入到来源于人类抗体的框架结构中,或许就能制造出“人源化”的抗体,从而尽可能减小其在人体内引起免疫反应的风险。
一旦有了想法,温特立刻就着手开展了研究。很快,他就设计出了一种合成基因,这种基因将一种结合活性已知的小鼠单克隆抗体的可变区和人骨髓瘤蛋白(一种在骨髓瘤患者中产生的抗体)的框架区结合在了一起。随后,温特及其团队成员通过寡核苷酸的化学合成和组装制造出了这种基因,并在骨髓瘤细胞中生成了这种人源化抗体。
受限于当时的技术,温特团队做完这一整套实验时,时间已经过去了18个月之久。但可喜的是,实验结果令人非常满意,这种人源化的抗体与提供可变区模板的小鼠抗体能够结合到相同的靶标上,并具有相似的结合亲和力。也就是说,这种人-鼠嵌合抗体初步达到了抗体人源化的目标!
在得到积极的结果后,温特团队迅速将另外两种来源于动物的抗体进行了人源化。其中一种抗体是针对淋巴细胞标志物的大鼠单抗。这一次,温特团队再次证明了这种人-鼠嵌合抗体的方法是可行的,经过人源化的大鼠抗体成功摧毁了两名非霍奇金淋巴瘤患者脾脏中的巨大肿瘤。
意识到人-鼠嵌合抗体的潜力后,多家公司采用这种新技术开发了一些用于治疗癌症和免疫炎症性疾病等非感染性疾病的抗体疗法。不过,当这些疗法进入临床后研究人员发现,虽然这种嵌合抗体的非人源成分更少,但人体免疫系统仍然会产生“中和抗体”,影响治疗效果。为了更好地治疗人类患者,药物开发人员需要进一步增加抗体的人源化比例或者开发出完全人源化的抗体。但问题是,该如何实现呢?
全人源抗体的诞生
幸运的是,生物学从未停下发展的步伐。1985年,美国生物化学家乔治·史密斯(George P. Smith)博士利用噬菌体开创了一种名为“噬菌体展示”技术。这种技术的原理很简单——首先,科学家在噬菌体的外壳蛋白基因序列中引入外源基因。随后,这些外源基因会与噬菌体外壳蛋白共同表达,并展示在噬菌体表面。这项天才的发明使研究人员能够方便快捷地克隆和扩增外源基因序列,温特却敏锐地意识到了它在抗体药物开发中的潜力——这项技术极有可能帮助他开发出符合期望的抗体药物。
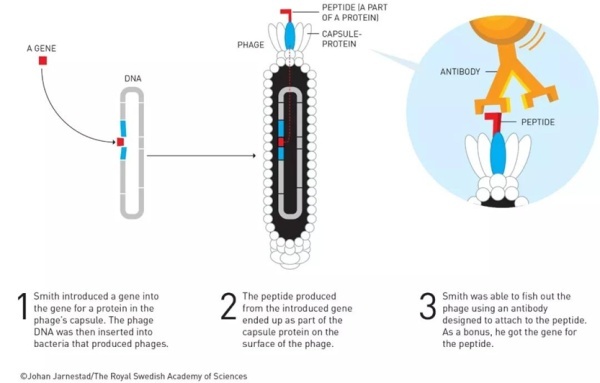
▲George P. Smith博士开创了“噬菌体展示”技术(图片来源:参考资料[6])
由于MRC分子生物学实验室在药物的临床开发方面无法为温特提供更多的资源,1989年,温特集结了各路对自己的抗体技术感兴趣的人马,成立了剑桥抗体技术公司(CAT),来加速技术的临床转化。
1990年初,温特团队迎来了突破,他们成功在噬菌体表面展示出了所需的抗体片段。然后,利用特异性的抗原把能与其结合的噬菌体筛选出来,就能分离和纯化出所需的抗体。经验证,这些通过噬菌体展示技术获得的抗体与动物来源的抗体具有相似的特异性和亲和力。这一重要成果被发表于《科学》杂志,引来了大量关注。此外这篇文章还指出,这种筛选方法将是革命性的。后来的故事也证实了,它毋庸置疑是革命性的。
利用噬菌体展示,温特团队首先创造出了一个大而多样化的抗体库。然后,他们利用特异性的抗原从库中筛选出那些携带更高亲和力的抗体片段的噬菌体,这些筛选出来的噬菌体的基因被引入随机突变后,由此产生的新一批的噬菌体将再次进入利用抗原进行筛选的过程,经过这样反复多轮的“演化”,通常就能得到具有所需特异性的抗体了。
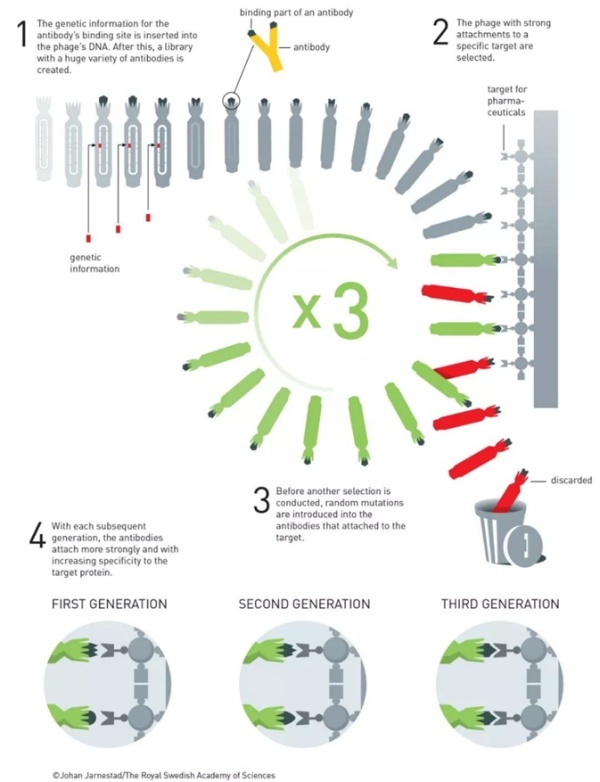
▲利用噬菌体展示进行抗体定向演化的原理(图片来源:参考资料[6])
得益于这种抗体定向演化技术,温特和同事们实现了鼠源抗体药物的完全人源化,开发出了首个利用“噬菌体展示”技术产生的人类抗体疗法——阿达木单抗。
拯救数百万患者的重磅疗法只是“起点”
据统计,全世界范围内有超过500万名类风湿关节炎患者。在阿达木单抗诞生前,他们常常面临进退两难的治疗状况。如果选择使用类固醇激素或非甾体抗炎药进行治疗,虽然能在一段时间内获得缓解,但诸如骨质疏松、糖尿病、肾衰竭、胃肠道损伤等副作用很快就随之而来。而如果选择停药,又会导致疾病复发。
后来研究人员发现,TNF-α是治疗类风湿关节炎的关键靶点,阻断TNF-α就可以明显缓解整个炎症反应。然而,在小鼠中疗效斐然的鼠源TNF-α抗体会引起人体的免疫反应,并不适用于人类。即使是经过人源化的人-鼠嵌合抗体,也依然无法达到研究人员的预期。
温特及其团队在开发出抗体定向演化技术后,立即将这种技术应用到了对TNF-α的动物抗体的改造上,改造获得的全人源化抗体就是后来的阿达木单抗。这款候选疗法以优秀的治疗结果通过了重重临床试验的考验,终于在2002年的最后一天获美国FDA的批准上市了。截至目前,阿达木单抗已有十余项适应症获批,在全球超过100个国家和地区被数以百万计的免疫疾病患者使用。
阿达木单抗的成功开发为温特的创业之路开了个好头,他创立的第一家公司CAT于1997年在伦敦证券交易所上市,后于2006年被阿斯利康(AstraZeneca)收购。2000年,为了开发他先前研究中发现的另一项技术,温特又成立了一家名为Domantis,专注于针对潜在的药物靶点筛选具有优秀的结合活性,且不容易聚集的单个抗体可变域。该公司于2006年被GSK收购。
2009年,温特创立了他的第三家公司Bicycle Therapeutics,该公司致力于双环肽偶联药物的研发。基于多年的抗体疗法开发经验,温特认为这种疗法存在着许多局限性,首先是它的分子量太大,很难深入渗透到组织中,其次是,它无法通过化学合成的方法制造。而双环肽分子就像是一种小的抗体模拟物体,能够集抗体、小分子药物及肽类的优点于一身——在具有与抗体类似的亲和性和特异性的同时,双环肽由于分子量较小,能快速深入地渗透组织。此外,双环肽的肽类性质提供了可调控的药代动力学半衰期和肾脏清除途径,避免了其他药物形式中常见的肝脏和胃肠道毒性。这一新分子模式单独就具有高亲和力、高选择性和高渗透性,若与其它药物分子偶联,或将碰撞出更令人惊喜的火花。
2019年,Bicycle Therapeutics成功登陆纳斯达克。近年来,Bicycle Therapeutics更是广受青睐,诺华(Novartis)、基因泰克(Genentech)、Ionis Pharmaceuticals等多家生物医药公司已与其达成合作协议。
对于为何要成立这么多家公司这一问题,温特的回答是,他希望看到自己的工作能够更多地被转化和应用,而学术研究机构在这方面的能力通常十分有限,通过公司进行转化可能是更好的选择。
在Bicycle Therapeutics上市的那一年,温特从三一学院院长的职位上卸任,对此他很高兴,因为他将有更多的时间继续投入到Bicycle公司,投入到创新技术的临床转化和新药开发中去……
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}