自从首款嵌合抗原受体(CAR)-T细胞疗法在2017年获得FDA批准以来,已有多款CAR-T疗法获得全球监管单位的批准,展现其治愈癌症的潜力。然而,这些获批CAR-T疗法的适应症多集中于B细胞类血液癌症,主要原因之一是由于靶向T细胞抗原可能会引发CAR-T细胞自相残杀(fratricide),进而影响整体治疗效果。然而通过单碱基编辑(base editing)技术,科学家已经开发出靶向T细胞的CAR-T细胞疗法,并在临床上获得验证。除此外,潜在靶向所有血液肿瘤类型的CAR-T疗法也已在临床前实验中展现积极抗癌效力。CAR-T疗法正在逐步且深入地扩展其在癌症治疗的应用。

图片来源:123RF
多重碱基编辑CAR-T细胞治疗T细胞癌症获临床验证
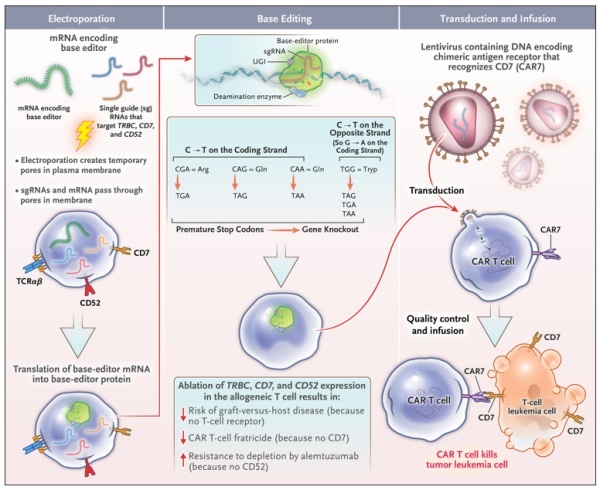
为了开发出用以治疗T细胞血液癌症且不会相互残杀的CAR-T细胞,来自大奥蒙德街医院(Great Ormond Street Hospital)的科学家团队使用胞嘧啶碱基编辑器(coBE)对T细胞进行多重编辑。这种胞嘧啶碱基编辑器将一种改变碱基的脱氨酶(deaminase)与无酶切活性的Cas9变体融合在一起,可在细胞内不产生DNA双链断裂的情形下制造C-G至T-A点突变,以产生过早终止密码子或破坏剪接位点来达到沉默特定基因表达的效果。▲通过碱基编辑制造靶向T细胞的CAR-T疗法(图片来源:参考资料[2])
该研究团队将靶向TRBC1和TRBC2(编码T细胞受体β链)、CD7和CD52 mRNA的3个单向导RNA(sgRNA)与编码coBE的mRNA,通过电穿孔的方式送入健康捐赠者的T细胞中,并接着使用编码CAR的慢病毒载体转染这些细胞,从而生成碱基编辑的靶向CD7的CAR(BE-CAR7)-T细胞库,用以治疗复发性或难治性T细胞急性淋巴细胞白血病(T-ALL)儿童患者。通过单碱基编辑破坏T细胞受体可防止CAR-T细胞攻击患者的常驻T细胞,进而避免移植物抗宿主病(GvHD)的发生。而通过敲除CD7的表达则可避免CAR-T细胞自相残杀。此外,CD52的失活则可确保患者在接受预处理方案中像是Campath(alemtuzumab)这类CD52靶向疗法治疗时,所接受的同种异体CAR-T细胞能够存活。这项1期试验中接受该疗法的前三位T-ALL儿童患者的治疗结果发布于去年的《新英格兰医学杂志》当中,其中两位患者在接受BE-CAR7治疗后一个月内达成完全缓解!首例患者是一名13岁女孩,她在接受同种异体干细胞移植后T-ALL产生复发,在输注单剂量BE-CAR7细胞后28天内实现了分子缓解。她后来接受来自原始捐赠者的低强度同种异体干细胞移植后,成功实现免疫重建和持久的白血病缓解。来自同一细胞库的BE-CAR7在另外两例患者中亦显示出有效活性,其中一例患者发生致命的真菌并发症,另一例患者则在缓解期间接受了同种异体干细胞移植。▲接受BE-CAR7治疗首位患者的疗效结果(图片来源:参考资料[2])
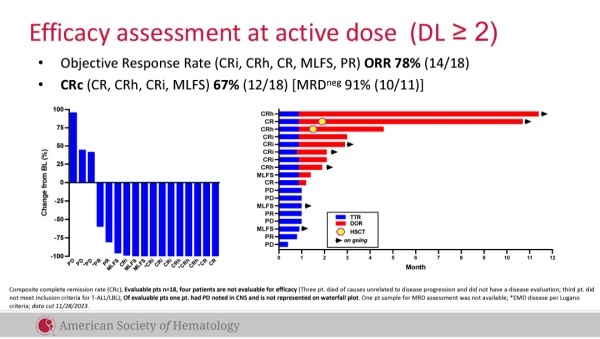
虽然在试验当中患者发生包括细胞因子释放综合征和机会性感染等严重不良事件,这项试验无疑证实多重单碱基编辑在临床应用上的可行性,并进一步扩展CAR-T疗法的应用范围。开发中的类似疗法还有Beam Therapeutics的BEAM-201。与BE-CAR7不同的是,除了对以上所提基因进行编辑外,BEAM-201还对T细胞的PD-L1进行编辑,目的是潜在避免T细胞耗竭与延长细胞存活时间,该疗法已在去年完成首次患者给药。此外,Wugen公司也在去年美国血液学会(ASH)年会上公布其经双重编辑的同种异体CD7靶向CAR-T疗法WU-CART-007用于治疗T-ALL或淋巴细胞淋巴瘤(LBL)的全球1/2期临床试验数据。分析显示,WU-CART-007表现出可控的安全性,未观察到GvHD。在剂量水平≥2的18例疗效可评估患者中,复合完全缓解(CRc)率为67%,接受推荐的2期剂量(RP2D)治疗患者的CRc为73%。▲WU-CART-007试验疗效结果(图片来源:参考资料[3])
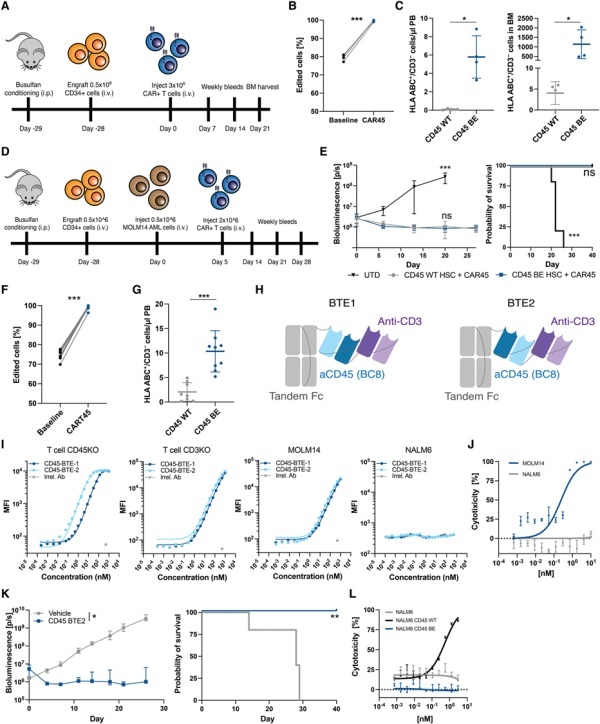
开发出能够潜在治疗T细胞癌症的CAR-T疗法是一项令人鼓舞的医学进展,然而单碱基编辑在创新CAR-T疗法开发上的应用不仅限于此。碱基编辑使得科学家能够在维持基因功能的同时引入单核苷酸改变,进而创造出新型的治疗靶标。这种方法被称为表位编辑(epitope editing),可进一步扩大CAR-T细胞疗法的范围,涵盖所有血液癌症,包括那些缺乏可靶向癌症特异性抗原的癌症。表位编辑的应用在去年8月两篇临床前研究当中获得初步证实。由宾夕法尼亚大学Saar Gill博士所带领的研究团队利用腺嘌呤碱基编辑器,将CD45蛋白转化为所有血液系统恶性肿瘤的可行CAR靶标。CD45是一种表达于几乎所有血液细胞表面的蛋白。研究人员将一种功能保留、可逃避CAR攻击的CD45安装到造血干细胞和CD45靶向的CAR-T细胞中。然后,他们将这两种经修饰的细胞输注入患有急性髓系白血病的小鼠体内。实验结果显示,CAR-T细胞可发动针对癌细胞专一性的攻击,且本身并不相互残杀,而经表位编辑的干细胞则在小鼠体内成功重建了一个健康的免疫系统。这项技术有潜力治疗任何血液或骨髓癌。Gill博士打算授权该技术或创建一家公司以将之进一步应用于临床。▲经表位编辑的造血系统不受CD45靶向CAR-T细胞攻击(图片来源:参考资料[4])
另一项研究则是由来自丹娜-法伯癌症研究所(Dana-Farber Cancer Institute)的Pietro Genovese博士所领导。他的团队同样采用了腺嘌呤碱基编辑器来创建造血干细胞,使得经编辑后的造血干细胞表面蛋白与白血病细胞所表达的蛋白仅存在一个氨基酸的差异。这一微小的变化使得小鼠体内的癌症得以根除,同时不影响正常的造血系统。Genovese博士打算启动一项临床试验,让急性髓系白血病患者接受经表位编辑的同种异体干细胞的移植。若日后患者的癌症复发,医生将能够在避免靶向与非靶向毒性的同时,用CAR-T细胞或其他疗法有效对抗癌细胞。以上这些研究显示,若能有效、策略性地将新兴技术相结合,则有望扩大治疗范畴,造福更多患者。随着学术界与产业界持续不断在单碱基编辑技术与CAR-T疗法上的改进,相信在未来会有更多癌症患者受惠,让我们共同期待。





{replyUser1} 回复 {replyUser2}:{content}