Nature:从结构上揭示TMEM16A激活机制,有望开发出新型囊性纤维化疗法
在一项新的研究中,来自瑞士苏黎世大学的研究人员利用低温电镜技术(cryo-EM)解析出氯离子通道TMEM16A的详细结构。这种蛋白是开发有效地治疗囊性纤维化(cystic fibrosis)的一种有希望的靶标。相关研究结果于2017年12月13日在线发表在Nature期刊上,论文标题为“Activation mechanism of the calcium-activated chloride channel TMEM16A revealed by cryo-EM”。
 图片来自Raimund Dutzler/UZH
图片来自Raimund Dutzler/UZH
囊性纤维化是一种严重的遗传性肺部疾病,目前还没有治愈它的方法。这种疾病的根本原因是氯离子通道CFTR发生功能故障,从而阻止氯离子从某些体细胞中分泌出。这会导致肺部中的粘液层脱水。一种治疗囊性纤维化的有希望的方法是活化钙离子激活的氯离子通道TMEM16A作为一种替代性的氯离子分泌途径。鉴于TMEM16A与CFTR一样都在相同的上皮中表达,它的活化能够恢复粘液层中的水合作用。TMEM16A和TMEM16爬行酶(TMEM16 scramblase)属于一个相同的蛋白家族,该蛋白家族的成员促进带负电荷的氯离子或脂质跨过细胞膜。
解析出一种氯离子通道的结构
作为一种脂质转运蛋白,TMEM16爬行酶在血液凝固中发挥重要作用。根据之前的研究,TMEM16爬行酶的结构是已知的。如今,在这项新的研究中,这些研究人员也成功地解析出氯离子通道TMEM16A的结构。为了做到这一点,Raimund Dutzler教授领导的一个团队使用了低温电镜技术(cryo-EM)。Dutzler强调道,“这种膜蛋白的分子结构对开发靶向治疗囊性纤维化的药物是至关重要的。”
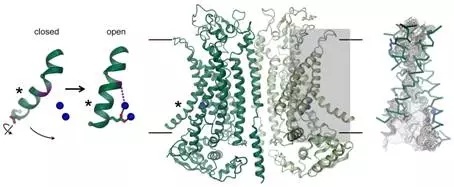
发现一种新的激活机制
氯离子通道TMEM16A能够在身体的不同器官中发现到,而且在肺部分泌氯离子、平滑肌收缩和疼痛感知中发挥着关键的作用。如今,这些研究人员通过组合使用cryo-EM和电生理学技术揭示出TMEM16A的结构如何不同于属于相同蛋白家族的存在密切同源关系的爬行酶,以及它是如何被钙离子活化的。尽管TMEM16A的总体结构类似于属于相同蛋白家族的爬行酶,但是位于这种二聚体蛋白的每个亚基中的离子渗透孔区域存在着显著的差异。爬行酶含有一种膜暴露的极沟(polar furrow),这就允许脂质头部通过脂质双层进行扩散。相反之下,在相同的位置上,TMEM16A形成一种沙漏状的蛋白包围通道,在没有钙离子时,这种通道是关闭的。带正电荷的钙离子在这种通道附近的结合让该通道打开,从而允许带负电荷的氯离子穿过细胞膜。论文第一作者Cristina Paulino解释道,“这种激活机制是独特的,这是因为钙离子的结合直接改变这种离子渗透孔的结构和静电性质。”
为开发新的药物铺平道路
这些描述了TMEM16A的结构和功能的发现为从机制上理解这种重要的膜蛋白家族铺平了道路,而且它们为开发治疗疗囊性纤维化的药物提供一种大有希望的模板。Dutzler陈述道,“导致TMEM16A活化的物质会弥补肺部中的氯离子分泌缺陷。”
原始出处:Cristina Paulino, Valeria Kalienkova, Andy K. M. Lam et al. Activation mechanism of the calcium-activated chloride channel TMEM16A revealed by cryo-EM. Nature, Published online:13 December 2017, doi:10.1038/nature24652
来源:生物谷


{replyUser1} 回复 {replyUser2}:{content}