Nature子刊:北大首次剖析甲基化动态,为理解人类早期胚胎发育奠定基础
一直以来,科学家们都在试图搞清楚遗传密码的作用。这些缠卷在一起的DNA分子,自身编码着非常重要的生物功能,即使不改变DNA序列,只是稍微给它们“化个妆”,比如说装上一个甲基“帽子”,也能够让它发生翻天覆地的变化。研究显示,DNA甲基化对多个生物学过程都至关重要,基因是否表达、是否能稳定传递、一些功能是否能够实现,甲基化都掺了一脚。
如果能搞清楚DNA甲基化的秘密,可以说我们离揭秘生命本源又近了一步。
今天,《自然遗传学》在线发表了北京大学生命科学学院汤富酬教授课题组、乔杰教授课题组的一项最新研究[1]。利用单细胞测序技术,我国的研究者们首次深度解析了早期胚胎发育过程中的去甲基化与从头甲基化的动态变化、亲本基因组甲基化差异,并提出了利用甲基化不对称性追溯细胞谱系的可能。
 从左至右为本项研究的通讯作者汤富酬、乔杰、闫丽盈
从左至右为本项研究的通讯作者汤富酬、乔杰、闫丽盈
本次研究中共测定了三大类共计480个细胞,平均每个细胞测量数据达到8.4GB、甲基化位点1080万个,可谓是数据浩如烟海。
诚如科学家们在文中所述,这项研究为破译早期人类胚胎DNA甲基化重编程的秘密铺平了道路。
研究成果:
①首次揭示早期胚胎发育过程中去甲基化与从头甲基化的动态平衡,且从头甲基化大量特异性集中在DNA重复序列区,这暗示DNA从头甲基化对抑制转座子活性、维护基因组稳定有重要作用。
②首次发现早期胚胎发育直至着床阶段过程中亲本基因组甲基化水平存在差异,母本基因组甲基化水平高于父本,这意味着母本基因组的甲基化水平对胚胎发育的潜在影响可能更大。
③首次利用胚胎细胞分裂过程中DNA甲基化的不对称分配追溯单个细胞来源,提出利用DNA甲基化水平追溯细胞谱系的可能性。
 去甲基化与从头甲基化
去甲基化与从头甲基化
想要搞清楚甲基化的秘密,没有别的方法,只能对基因进行逐个分析。北大的汤富酬教授和乔杰教授团队就一直在做着这样的事情。
2014年,两位科学家联手登上《自然》杂志,在国际上首次实现了对早期胚胎发育DNA甲基化的系统研究[2]。在这项研究的基础上,研究者采用了全基因组重硫酸盐(PBAT)测序技术,这项技术允许对小量级别(1ng)以下的DNA进行甲基化水平测量,这解决了胚胎内单个细胞之间甲基化程度不均一的问题,在单细胞、单碱基的分辨率上清晰展现了DNA甲基化图景。
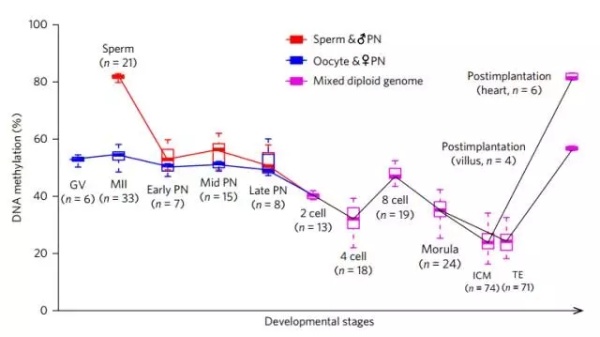 早期胚胎发育过程中甲基化水平变化
早期胚胎发育过程中甲基化水平变化
我们都知道,在胚胎发育的初期,也就是受精卵形成之后,来自亲本的基因组会经过一次“大清洗”,整体进行去甲基化处理,这也是为什么父母的基因甲基化很少会遗传给孩子的原因。研究者发现,这种去甲基化是分三个时段进行的。
第一次大规模的去甲基化发生在受精后10-12小时,这时父本基因的甲基化水平会从82.0%降到52.9%,母本基因则会从54.5%降低到50.7%。此时去甲基化主要发生在增强子和基因主体区域(gene body)。
第二次去甲基化发生在受精卵晚期到二细胞时期,此时基因组的甲基化水平从49.9%降低到40.4%;第三次去甲基化发生在八细胞时期到桑葚期,基因组甲基化水平从47.0%降低到35.1%。这两次去甲基化主要发生在内含子和各种DNA重复序列上(基本是转座序列)。
有细心的读者可能注意到了,这三次去甲基化之间,DNA甲基化水平的数据并不连续啊?因为,在这三块去甲基化“饼干”中间,还夹着两次从头甲基化“夹心“呢。
在生殖细胞原核融合在一起的过程中,会发生一次从头甲基化;在四细胞时期到八细胞时期中,发生了另一次从头甲基化。根据研究者测量得到的数据,这两次大规模甲基化中,涉及到的基因分别是19861个和53437个!
这些从头甲基化的基因看起来十分有目的性,也是主要集中在DNA重复序列上(包括短散在序列、长散在序列、长末端重复序列等),好像是在刻意遏制这些重复序列的活性,防止激活转座子,用这种方式来维护基因组的稳定。
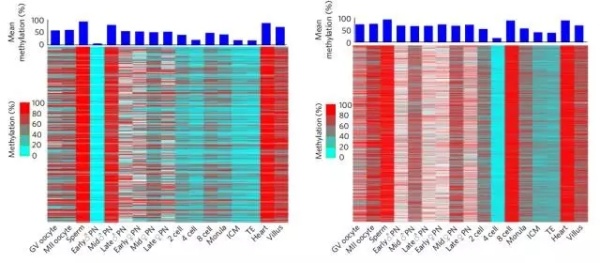 两次从头甲基化基因的动态变化
两次从头甲基化基因的动态变化
有趣的是,经过了从头甲基化的基因也并不是一直保持着甲基化的状态,它们很有可能在下一波去甲基化浪潮中又被还原了,可见去甲基化与从头甲基化是一种动态平衡,最终胚胎呈现的整体甲基化水平是这种动态平衡等号之后的产物。
亲本基因之间的甲基化差异
在分析胚胎甲基化水平的过程中,研究者发现了一件很有意思的事——亲本基因之间的甲基化水平竟然很不一样!在第一次去甲基化浪潮中,父本甲基化水平暴跌29.1%,母本只下降了3.8%!
研究者排除了一些印记基因(ICRs)的影响。这些基因会根据来源产生表达差异。比如说,同样的一个等位基因,来自母本的会表达,来自父本则不表达。但是排除了之后,这种差异依旧存在。
在胚胎形成的最初,父本基因甲基化水平可是远远高于母本的,但是随着细胞生长分裂,等到二细胞时期,母本的基因甲基化水平(23.0%)就会反超父本(15.2%),并且这种现象会一直持续。
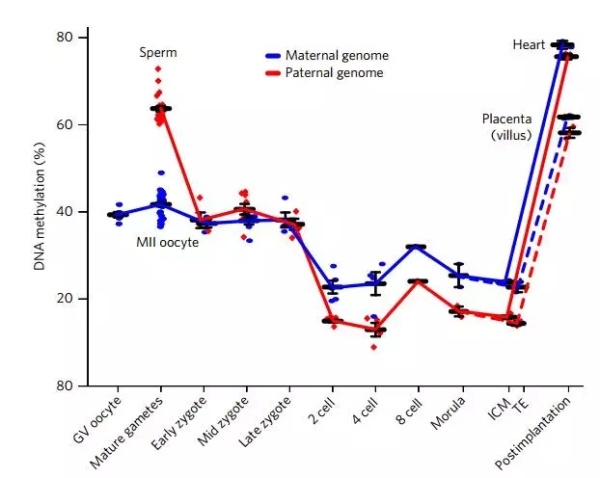 亲本基因甲基化动态变化
亲本基因甲基化动态变化
研究者还同时测量了内细胞团(ICM)和外胚层(TE)的甲基化水平。结果显示,内细胞团中母本与父本的甲基化水平分别为78.6%和76.6%,在外胚层则是67.0%和58.5%,差异更大了呢!
研究者猜测,这种甲基化的不对称性,可能说明了来自母本的甲基化“记忆”对胚胎、尤其是胎盘的发育影响更大,可能会影响到一些亲本特异性基因的特征。不过根据研究者给出的数据,这似乎暂时不影响特异性基因的表达(ASEs)。
利用甲基化追溯细胞谱系
考虑到细胞内甲基化水平的动态变化和等位基因甲基化的不对称性,那么不同细胞的子代细胞之间应该也会存在甲基化水平的差异。如果真是这样,我们就可以通过测量单个细胞的甲基化,来追踪它到底是从哪来的了。
为了验证这个猜想,研究者给小鼠胚胎做了点手脚。在二细胞时期,研究者给两个细胞中的一个注射了一些荧光标记(异硫氰酸标记的葡聚糖,FITC-coupled dextran)。这样,两个细胞中只有一个会发光,它分裂出的子代细胞也会发光。
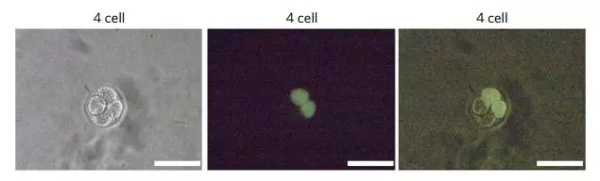
发光的胚胎细胞,比例尺100μm
当这个二细胞时期胚胎发育到四细胞时期,研究者给四个细胞分别测序,结果不出所料,不同来源的细胞表现出的明显的负相关性,可谓是一眼就能看出哪个是亲生的。这表示,利用甲基化来探查早期胚胎细胞的出身,并不是个梦。
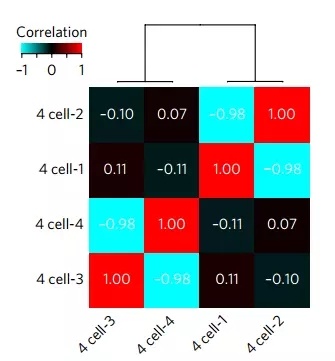 四个细胞之间相关性,越红越“亲生”
四个细胞之间相关性,越红越“亲生”
北京大学生命科学学院生物动态光学成像中心朱平博士(现为中国医学科学院血液病医院血液学研究所副研究员)、郭红山博士、侯宇博士,以及北京大学第三医院博士生任一昕为该论文的并列第一作者;北京大学生命科学学院汤富酬研究员、北京大学第三医院乔杰教授、闫丽盈研究员为该论文的共同通讯作者。该项研究得到了国家自然科学基金、国家重大科学研究计划、北京市科学技术委员会、国家高技术研究发展计划、北京未来基因诊断高精尖创新中心的资助。(作者信息来自北大生科院)
参考资料:
[1]Zhu, P., Guo, H., Ren, Y., Hou, Y., Do, J., Li, R., Lian, Y., Fan X., Hu, B., Gap, Y.,et al.(2017). Single-cell DNA methylome sequencing of human preimplantation embryos. Nature Genetics.
[2]Guo, H.,Zhu, P., Yan, L., Li, R., Hu, B., Lian, Y., Yan, J., Ren, X., Lin, S., Li, J., et al.(2014). The DNA methylation landscape of human early embryos. Nature511, 606-610.
来源:奇点网


{replyUser1} 回复 {replyUser2}:{content}