Science:首次从结构上揭示帕金森病的关键组分的毒性产生机制
在一项新的研究中,来自英国、意大利和西班牙的研究人员观察到与帕金森病相关的毒性蛋白聚集物如何破坏健康的神经元的细胞膜,导致它们的细胞壁出现缺陷,最终导致一系列诱导神经元死亡的事件。相关研究结果发表在2017年12月15日的Science期刊上,论文标题为“Structural basis of membrane disruption and cellular toxicity by α-synuclein oligomers”。论文通信作者为英国帝国理工学院的Alfonso De Simone博士和剑桥大学的Christopher Dobson教授。
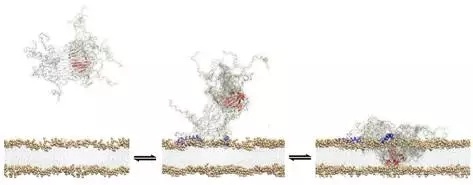 图片来自Alfonso De Simone
图片来自Alfonso De Simone
这项研究探究了所谓的毒性寡聚物,即当单个蛋白错误折叠并聚集在一起时出现的蛋白分子聚集物。就帕金森病而言,所涉及的蛋白是α突触核蛋白(alpha synuclein)。当α突触核蛋白发挥正常功能时,它在大脑内的信号转导中发挥着重要作用。
这些蛋白聚集物的形成和扩散被认为导致这种渐进性疾病的分子机制中的一个关键组分。理解它们如何进入和破坏细胞为开发新的更加有效的药物提供了机会。但是迄今为止,研究它们如何破坏脑细胞是比较困难的,这是因为它们通常是不稳定的。在形成后不久,它们要么土崩瓦解,要么组装成更大的对单个细胞破坏较小的结构。
在这项新的研究中,这些研究人员能够让α突触核蛋白寡聚物在足够长的时间内保持稳定以便以前所未有的细节研究它们如何破坏脑细胞。他们鉴定出这种寡聚物的一种允许它附着到细胞壁上的特异性特征和一种“结构核心”,随后便取得突破性的研究结果。
De Simone解释道,“这是蛋白寡聚物的一个共同的特性:一旦结合到脑细胞的表面上,它们能够破坏这些脑细胞。当这种寡聚物与细胞膜接触时,它就会破坏细胞膜的完整性,这是导致神经元死亡的机制的一个关键步骤。”
剑桥大学圣约翰学院博士后研究员Giuliana Fusco博士说,“仅获得这种信息并不意味着我们如今能够去开发一种药物,但是明显的是,如果我们能够理解这些蛋白聚集物为何具有这样的行为,那么我们就能够在治疗帕金森病方面取得更快的科学进展。这意味着我们能够采取一种更合理的方法来进行药物研发。”
毒性蛋白寡聚物是在导致帕金森病的一系列事件的早期阶段形成的,而且据认为这种形成过程是当α突触核蛋白出现功能故障并开始粘在一起时启动的。在这种情形下,它们的出现对神经元功能是致命性的。一旦这些寡聚物形成,它们就会扩散,从而允许初始的毒性寡聚物扩散到其他的细胞中。
在这项新的研究中,这项研究人员在实验室中利用固态核磁共振光谱技术(solid state nuclear magnetic resonance spectroscopy, SSNMR)研究了有毒性的和无毒性的α突触核蛋白样品。这种技术近期取得的进展能够让他们以前所未有的细节研究这些蛋白寡聚物。他们描述这些寡聚物的不同特征,随后研究了这些不同的特征如何影响它们与从大鼠中提取出的脑细胞之间的相互作用,以及它们与从人脑瘤中提取出的细胞之间的相互作用。
特别地,这项研究的结果可能有助鉴定出能够攻击这些破坏性的α突触核蛋白寡聚物因而对它们的影响加以限制的分子。今年10月,剑桥大学成立了一个新的错误折叠疾病中心,致力于开发治疗包括帕金森病在内的一系列疾病的治疗策略。它的大部分工作将建立在像这样的研究之上,从而加深对神经退化背后的基础过程的科学理解。从这一点而言,科学家们能够鉴定出可能在未来的药物中使用的分子候选物,而且如果需要的话,针对特定的疾病对它们加以优化。
Dobson教授说,“关于这项研究的真正令人激动人心的事情之一是确定一种神经退行性疾病中的至关重要的致病性分子的结构是可能的,而且我们也成功地提出它的毒性产生机制,从而为寻求合理的治疗策略提供了重要的线索。”
原始出处:Giuliana Fusco, Serene W. Chen, Philip T. F. Williamson et al. Structural basis of membrane disruption and cellular toxicity by α-synuclein oligomers. Science, 15 Dec 2017, 358(6369):1440-1443, doi:10.1126/science.aan6160
来源:生物谷


{replyUser1} 回复 {replyUser2}:{content}