FDA批准首款用于遗传性失明的基因疗法,定价或达100万美元
当地时间12月19日,美国食品药品监督管理局(FDA)批准通过了一项针对遗传性视网膜病变的基因疗法,这项由Spark Therapeutics公司研发的Luxturna疗法,是美国批准的首个针对特定突变基因的基因疗法。目前,该疗法的价格尚未公开。据华尔街分析师预测,其定位可能在一百万美元。
遗传性视网膜病变(IRD)是一类由基因缺陷导致的视力疾病,在220多种与视力相关的基因中,任何一个基因的突变都将导致IRD。其中,RPE65基因负责编码视觉过程中的一种关键酶(RPE65),RPE65基因的突变会导致酶活性下降,阻断视循环,并引起严重的视力疾病。随着疾病的发生,患者会逐渐失去功能性视觉,甚至最终完全失明。
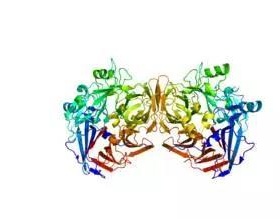 RPE65酶的3维结构
RPE65酶的3维结构
Spark Therapeutics公司研发的Luxturna,通过一种天然存在的腺相关病毒载体,将正常的RPE65基因注射进患者眼部,以替代或者覆盖有缺陷的致病基因、促使患者产生正常的RPE65酶,以恢复丧失的视力。
在已经进行的3期临床试验中,31位患IRD的受试者在接受Luxturna治疗一年之后,在弱光环境下通过障碍测试的能力有显著提高。
Luxturna
此前,Luxturna已经在FDA专家团的投票中,获得了16:0的一致认可。12月19日,FDA正式批准Luxturna上市。FDA对Luxturna的上市许可,无论是科学还是经济意义上来说都有里程碑式的意义。Luxturna成为美国首个被批准针对特定突变基因开展的基因治疗手段。
Spark公司的发言人表示明年1月之前都不会公布Luxturna的价格。华尔街分析师预测这项基因治疗可能定位在一百万美元,价格和以前的首发治疗一样不会太低。目前药物价格都是严格监管控制的,Spark公司需要证明给保险业、政治家和药物评判者们,这项Luxturna带给病人的好处值得起这个价钱。
“FDA的许可意味着基因治疗又走出了新的一步,这一步包括治疗手段如何运作并且治疗对象从癌症患者走向了失明患者。这项里程碑式的举动,也为基因治疗朝着攻克更加宽广的疑难杂症方向前进,打下了坚实的基础。”FDA局长Scott Gottlieb在发言中表示。
根据彭博资讯,华尔街的分析师预测2018年Luxturna销售额将达到7800万美元,2019年达到2亿3800万,最顶峰时期将有4亿4500万。由于目前还不确定Luxturna的价格和报销比例,这些预测也存在着很大的不确定性。
而在Luxturna获批准上市的消息公布之后,Spark股价目前上涨了4个百分点,达到50.82美元。


{replyUser1} 回复 {replyUser2}:{content}