|
2017-10-15 05:33:07
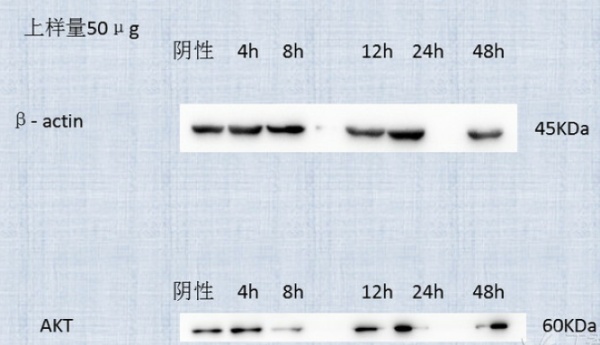
Western Blot始终跑不出理想的Actin和AKT条带,是什么原因1.本人原代提取的牛肺动脉内皮细胞(PAECs)及肺动脉平滑肌(PASMCs)细胞用于实验,分时间段对细胞进行炎症模型的建立(阴性,4h,8h,12h,24h,48h),造模后提取蛋白。2.蛋白提取:直径60mm的培养皿,裂解液(RIPA:PMSF=100:1)50μl/皿,超声裂解,离心(4℃,12000g,15min),-80℃保存。BCA法测蛋白浓度,酶标仪检测各蛋白OD值,计算蛋白浓度,50μg上样量用于跑western。 3.片段大小:actin 45KDa, AKT 60KDa4.配胶:10%分离胶(凝30min左右),5%浓缩胶(凝10min左右),保鲜膜包裹,4℃,次日使用。 5.跑电泳时刚开始60U,待marker分开始调整至120U,转膜恒流230mA,2h左右,丽春红染色,TBST洗净后封闭2h(5%脱脂奶粉,TBST配制)。 6.抗体:一抗CST的β-Actin Rabbit mAb,1:1000稀释,4℃过夜,说明书 Species Cross-Reactivity中有Bovine这一项,跟我的应该是匹配的。次日室温孵育1h,TBST洗3遍,孵育二抗。 二抗G-a-R(H+L),1:5000稀释,2h。一抗,二抗前后都用TBST洗3次,10min/次。7.曝光:我们科里有专门的机器,发光液前几次用的BeyoECL Star A液和B液,最近几次用了万类生物的ECL超敏发光液。 下面这些是我的实验结果,尤其AKT条带实在不尽人意,我很注意每个细节,真心不知道哪个环节出问题了,所以很苦恼。
|
7个回答
|
我们实验室在跑WB过程中也会出现这样的条带,我自己觉得原因如下: 1.在上样过程中上样孔内有异物,没有提前冲上样孔,导致曝光后条带出现深浅不均匀的情况。2.发光液没有滴加均匀,可以将膜放在封口膜上,滴加发光液使其均匀分布在膜上再进行曝光。总结:个人出现这样的原因与上样关系密切。 |
|
除了Fig。2 其它5张图的内参(actin)并不能显示你的上样量是均一的(这和你事实上样量是否一致没有关系,用最终结果说话),提示你的实验体系并不是很ok,建议先优化内参,等内参一致提示你实验体系ok了,再说你测的Akt的事情。WB步骤前后多大二十几步,确实不好控制。 |
|
1.由同一盘或一瓶细胞分到对照组和实验组,最好是不同时间点处理,同时收细胞。2.若排除蛋白定量不准以及操作因素之后,考虑actin的表达会受到实验处理的影响,建议换种内参试试。3.上面两点做好之后,若AKT依然不整齐,考虑AKT总蛋白的表达可能受到实验处理因素的影响。 |
|
这其中部分蛋白是查缺补漏的,就是哪个时间段的没了,我就重新提取用于实验的。”这样做是极其不好的。你可以试试,再重新提取一个还有的,相同时间段,不同批次提取的,看表达是否一样。 |
|
我们实验室在跑WB过程中也会出现这样的条带,我自己觉得原因如下:1.在上样过程中上样孔内有异物,没有提前冲上样孔,导致曝光后条带出现深浅不均匀的情况。2.发光液没有滴加均匀,可以将膜放在封口膜上,滴加发光液使其均匀分布在膜上再进行曝光。总结:个人出现这样的原因与上样关系密切。 |
你的回答
| 提问时间: | 2017-10-15 |
| 浏览量: | 4865 |
| 最近回答: | 2017-10-15 |