|
2025-03-15 00:57:34
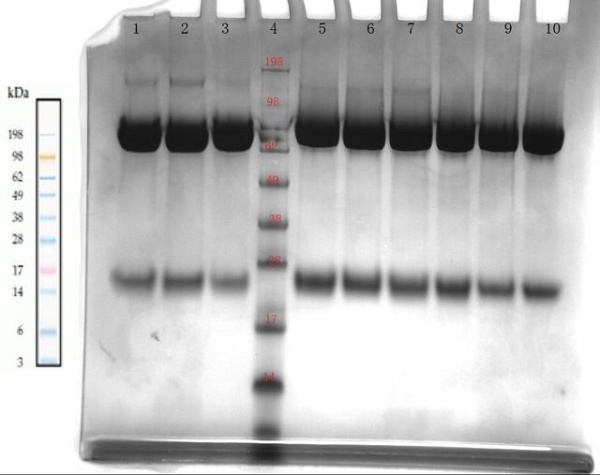
用 TOSOH G3000SWxl测定蛋白分子量纯度结果与电泳结果差异大,为什么?最近在做一蛋白,利用电泳和SEC分别鉴定其分子量纯度,发现两者对应不上,特来请教。 电泳产用invitrogen的BIS-TRIS 8-12%预制胶,前三道非还原,后三道还原 所得结果如图 。目的蛋白理论分子量约90Kd,电泳图中有约150Kd及22Kd的杂带,此图与预期吻合。
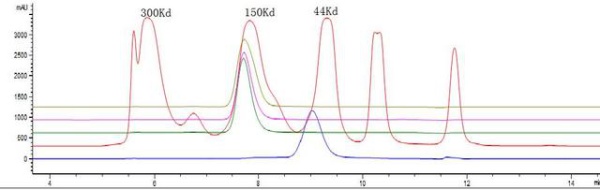
但产用TOSOH G3000SWxl分离时 只出一个峰(按电泳结果至少三个峰),且出峰位置分子量约150Kd ,色谱条件为200mM PB6.8 , 用BIORAD 标准Mark对照,同时进了一针理论分子量为44的蛋白,出峰位置基本一致 图谱如下:
特请教各位,关于这两种方法测定结果差异的原因,SEC的结果出峰位置不对且峰数量少?
|
4个回答
|
电泳结果是在对蛋白做了处理之后得到的结果,因为加了SDS和巯基乙醇啊,已经不是原本的结构了。而SEC是对原始状态的分析,有差别很正常。说明目标蛋白具有一定的空间结构。 |
|
SEC检测经常会有这样的情况的,分子量在两倍内的蛋白经常出现一起出峰的情况。我们做抗体就经常遇到,SDS电泳能明显看到有轻链条带的,但是SEC结果确完全没有这个。但是通常SEC测二聚体多聚体跟单体能与SDS-page电泳比较吻合(这个同样的也是两倍分子量的差别),个人猜测这跟填料的孔径分布相关。而SDS-PAGE电泳对于片段这些分子量小的杂质能跟毛细管电泳的结果有很好的对应,但是在二聚体或多聚体上两者表现又是不一致的。所以我们通常是这三种方法联合使用,判断样品情况。 |
|
你这是梯度胶,感觉marker是不是标错了,建议电泳中加入bsa这类已知蛋白确定一下marker的位置,如果没问题,那就和大家说的,可能和蛋白的空间结构有问题,蛋白的3级结构没有打开。 |
你的回答
| 提问时间: | 2025-03-15 |
| 浏览量: | 1014 |
| 最近回答: | 2025-03-15 |
相关问题
{title}
投票 {vote}
DSC异常放热峰问题是什么造成的?
回答 5
如何判断药物的疏水性和进入细胞的能力?
回答 5
疫苗在远期有增加诱发癌症的危险吗?
回答 4
如何理解管桩的怪异现象?
回答 6
灭菌后的发酵培养基浑浊了,什么原因?
回答 3
怎么样把产品从甲醇-甲苯溶液中析出来啊?
回答 3
WB转膜后marker飞了是什么原因?
回答 4
岩石边坡的土拱效应
回答 4