5个回答
|
很简单的问题,原因也很简单,做胶的时候不注意细节。 这种情况一般出现在拔底面spacer(大板胶通常有底部的封条)和样孔梳子的时候。原因有四种可能:
|
|
因为你的胶板没做好,当然跑任何人的样品都会漏样。“效果还可以”,真的不知道你是怎么判断的,如果样品漏掉,基本该lane就作废了,一组实验如果是一个重要的ctrl或者positive group,一次结果就报废了。其实,关于玻板要洗干净之类,我懒得去提;这是最基本的常识,应该不用特别提醒才对。如果这点做不到,想做好实验或者说让实验很稳定,我想是很难的,玻板未洗净的坏处很多。尽管玻璃看似平滑,但是一些细微的凹陷处会凝结肉眼无法分辨的胶颗粒(摸上去疙疙瘩瘩),其坏处是,在该部位极易导致不均匀的胶块,样品经过该处或电泳散热不好,条带变形。如果是RNA的超薄胶,胶板的颗粒会导致局部巨大气泡,非常难于清除;蛋白胶也会导致一些小气泡的产生。懒得提不等于这点不重要,不干净=不光滑,玻板不光滑直接影响粘粘的牢固程度。顺便说一句:因为玻板干净很重要,我从来不会拿公用的。我会自己keep一套自己专用,每次自己用洗洁精(非洗衣粉,洗衣粉洗不干净玻板)清洗,放在自己的bench上晾干——这些都是常识。实际上,上一次回答中我就已经告诉过你这个问题的解决方案,你的核心目的是尽量减小板间错动。那么灌胶的时候,先插好梳子再夹到胶槽上——再灌胶。如果你要问梳子插上去了怎么灌胶?先插一半总可以吧。当然压胶液体的清除相对麻烦,如果是异丙醇似乎必须清除干净,那么你可以使用台式真空泵;如果没有多用几张吸水纸。然后灌堆积胶,堆积胶灌好后,再把梳子全压进去。然后电泳缓冲液中拔梳子(比水更好,有SDS润滑)。至于你觉得那个正确的答案:他唯一可行的地方就是干净的玻板;磨损小的玻板==光滑,干净==光滑,玻璃介质表面光滑的时候黏附最紧——中学的物理常识。PS:RIPA用过<3次,均未出现你说的现象。不再纠缠这个问题了,哎! |
|
其实大家说的都有道理,但该问题的发生根本还是在制胶过程。如果你观察细致的话,就可以发现,某个泳道漏下来,也只是漏到了积层胶与分离胶交界的部位,而且你若是低电压压的话,到了分离胶情况就有所好转。所以根本原因还是用来压平分离胶的液体没有清除干净。解决办法:分离胶制好后,不管是用水压(我就用水)还是别的什么,再灌积层胶前,是很难清除表面那一层的。所以,只要在灌积层胶之前,先取少量胶液灌进胶板,迅速轻轻左右晃几下,让液体充分沾上分离胶上层,再把这些胶液去掉,然后再正式灌满积层胶,插进梳齿。问题就解决了。我说的很复杂,其实很简单,就是先用积层胶的液体润一下就行了。我的经验是积层胶的AP和TEMED先不加,去水,再加AP和TEMED,混匀,第一次灌少量,晃几下,去除,再正式灌满。整个动作要快要轻柔。试试吧,肯定可以。 |
|
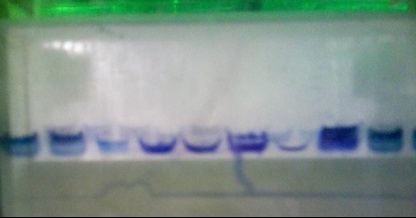
看图后有以下意见: 1 第6道加样时可能是加样器尖部刺穿了胶底部,所以漏了。 2 蛋白样品没有和上样缓冲液充分混合。 3 制胶时,要充分混匀,使得胶的质地均匀。 |
你的回答
| 提问时间: | 今天 |
| 浏览量: | 1443 |
| 最近回答: | 今天 |